引言
MA市场准入·解决方案系列 「神经介入」②颅内弹簧圈产品 ——临床评价路径、技术审评关注点、已获批产品等🌈根据《医疗器械临床评价技术指导原则》可知,临床评价的路径主要包括:免临床评价(豁免临床)、临床试验、同品种等同性论证(简称同品种)三种路径。【MA市场准入系列】根据不同临床领域的医疗器械划分,对其临床评价路径及相关政策等进行梳理,包括神经介入、心脑血管、人工智能、医美、肿瘤、骨科、眼科等,旨在帮助大家更好的了解产品上市流程。

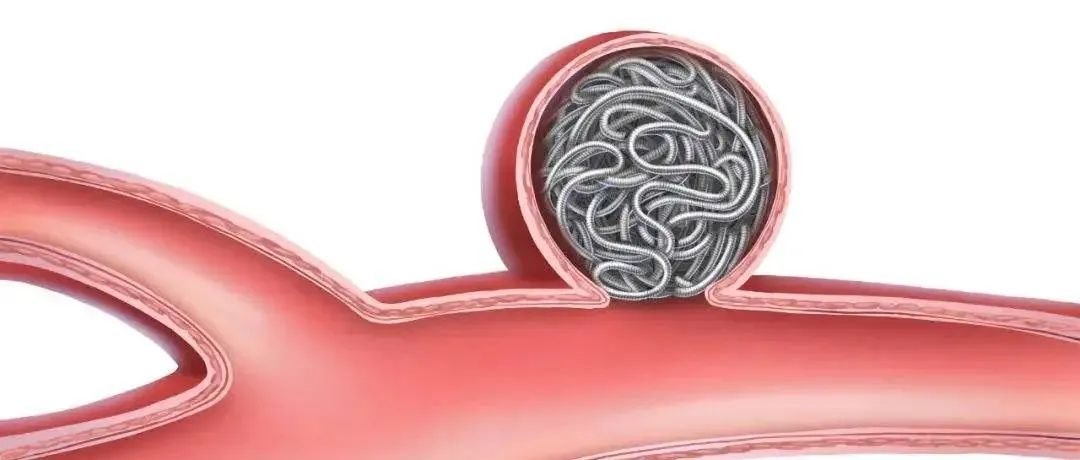 颅内动脉瘤,是一种神经外科常见的脑血管疾病,常称为颅内“不定时炸弹”,指的是颅内动脉血管壁的薄弱处,在血流和血压的作用下,向外异常膨出,样子形似肿瘤,故被称为动脉瘤。颅内动脉瘤并非真正的肿瘤,但一旦破裂,则病情危重,比如剧烈头痛、恶心呕吐、抽搐和意识障碍等,甚至死亡。对于颅内动脉瘤的治疗主要包括开颅夹闭和介入栓塞。颅内动脉瘤介入栓塞治疗最常用的材料是弹簧圈,弹簧圈是一种铂金材质的金属丝,质地柔软。在栓塞手术中,将一根微导管插入动脉瘤腔内,然后用推杆将弹簧圈经微导管推入动脉瘤腔内,其工作原理为通过微创伤入路,向动脉瘤内填塞弹簧圈形成血栓,使瘤内血流停滞,从而减少动脉瘤内压力,防止瘤体破裂。颅内弹簧圈根据《医疗器械分类目录》,分类编码为13-06-08,属于Ⅲ类医疗器械。
颅内动脉瘤,是一种神经外科常见的脑血管疾病,常称为颅内“不定时炸弹”,指的是颅内动脉血管壁的薄弱处,在血流和血压的作用下,向外异常膨出,样子形似肿瘤,故被称为动脉瘤。颅内动脉瘤并非真正的肿瘤,但一旦破裂,则病情危重,比如剧烈头痛、恶心呕吐、抽搐和意识障碍等,甚至死亡。对于颅内动脉瘤的治疗主要包括开颅夹闭和介入栓塞。颅内动脉瘤介入栓塞治疗最常用的材料是弹簧圈,弹簧圈是一种铂金材质的金属丝,质地柔软。在栓塞手术中,将一根微导管插入动脉瘤腔内,然后用推杆将弹簧圈经微导管推入动脉瘤腔内,其工作原理为通过微创伤入路,向动脉瘤内填塞弹簧圈形成血栓,使瘤内血流停滞,从而减少动脉瘤内压力,防止瘤体破裂。颅内弹簧圈根据《医疗器械分类目录》,分类编码为13-06-08,属于Ⅲ类医疗器械。
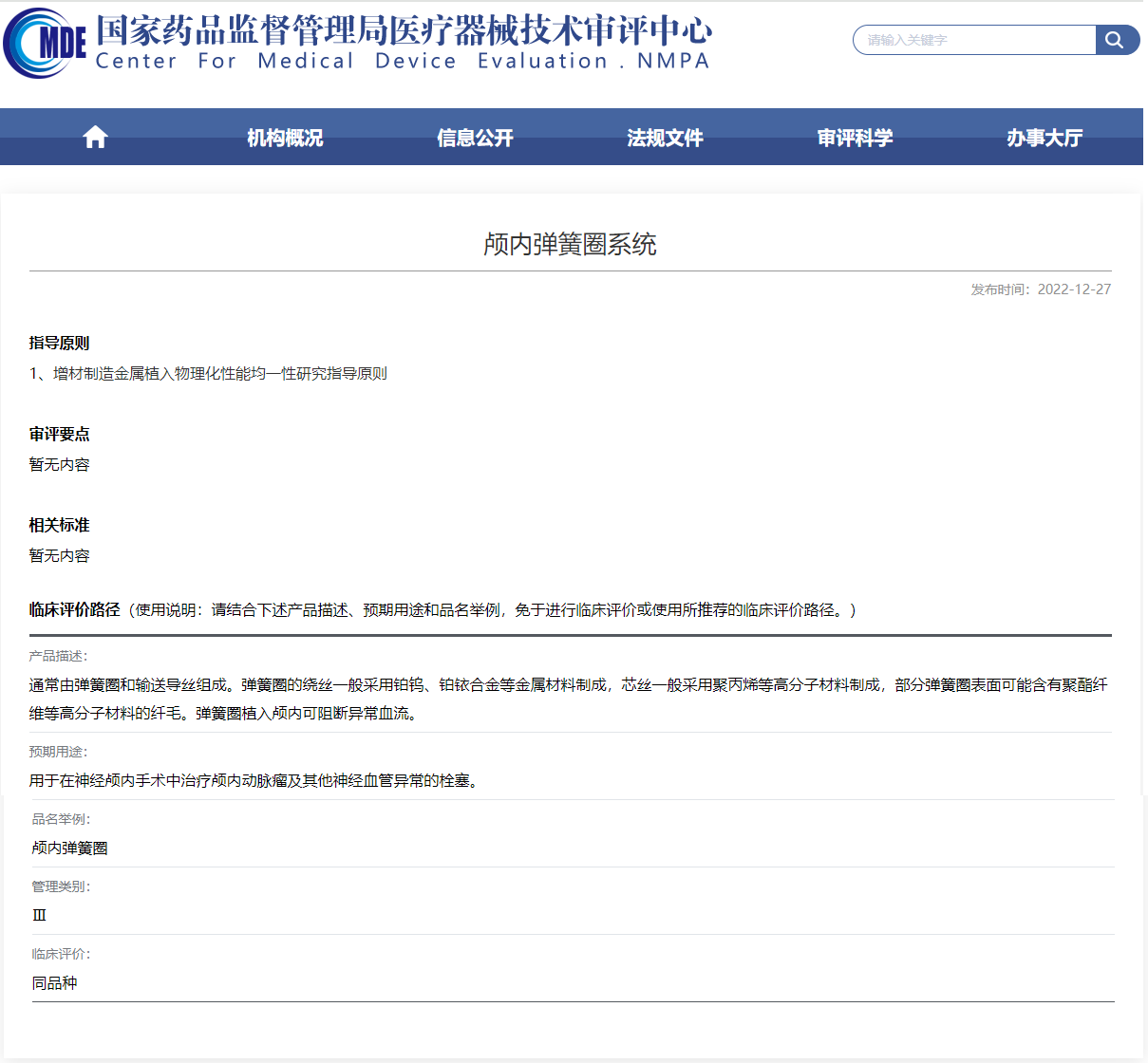 国家器审中心关于颅内弹簧圈的临床路径概述
国家器审中心关于颅内弹簧圈的临床路径概述
研发企业
史赛克、美敦力、强生、美科微先公司、沛嘉医疗、微创神通、维心医疗、通桥医疗、沃比医疗、加奇生物、秦杰伟业、南京思迈德等。

临床评价概述
该产品以临床试验和同品种对比结合的方式进行临床评价,并提供了境外上市后临床数据。针对颅内动脉血管病变,申请人采用临床试验路径进行临床评价;基于在颅内应用的临床试验中充分评估申报产品的输送、填塞等效果的基础上,针对外周血管病变,申请人选取临床试验时的对照产品作为同品种产品,结合申报产品和同品种产品性能对比、动物实验、申报产品在境外上市后的临床数据等支持资料,采用同品种比对路径进行临床评价。
临床试验结果
临床试验目的为评价申报产品用于颅内动脉瘤血管内栓塞治疗时的安全有效性。该临床试验为多中心、随机、开放、平行对照的非劣效设计,主要评价指标为术后 6 个月动脉瘤闭塞率;次要评价指标为技术成功率、术后即刻动脉瘤闭塞率、改良 Rankin 评分;安全性指标为(术后 1-7 天、术后 3 个月、术后 6 个月及术后 12 个月)死亡、卒中及再次脑出血发生率、不良事件发生率、实验室检查指标、生命体征。该试验在 10 家临床试验机构开展,实际入组 324 例。主要评价指标:术后 6 个月动脉瘤闭塞率:FAS 集(试验组 97.55%,对照组 98.14%),PPS 集(试验组 97.74%,对照组 98.52%),两组动脉闭塞率差值置信区间下限均未超过非劣效界值-10%。次要评价指标:术后即刻闭塞率:试验组为 95.71%,对照组为 94.41%,两组间无统计学差异;技术成功率:试验组为 100%,对照组为 99.79%,两组间无统计学差异;术后 1-7 天、术后 3 个月、术后 6 个月及术后 12 个月改良 Rankin 评分,两组间无统计学差异。
同品种比对结果
经过比对,申报产品和同品种产品在与弹簧圈和抗拉组件的连接方式、弹簧圈与推送杆连接区域设计、推送杆远端设计、推送杆近端设计等方面存在差异。针对上述差异,申请人提交了相关的非临床研究资料包括机械解脱弹簧圈产品性能确认报告、机械解脱弹簧圈对比测试报告及性能验证报告、动物试验等,提交了申报产品在境外上市后的临床数据(包括上市后随访研究、上市后的投诉与不良事件报告等),证明差异不对申报产品安全有效性产生不利影响。
【常见咨询问题举例】
1、弹簧圈产品注册单元划分的原则是什么?
颅内弹簧圈注册单元划分建议依据《医疗器械注册单元划分指导原则》进行,并着重考虑产品的技术原理、结构组成、性能指标及适用范围等因素,如:
(1)解脱方式:机械解脱弹簧圈、电解脱弹簧圈、热熔解脱弹簧圈、水解脱弹簧圈宜划分为不同的注册单元。
(2)结构特点:带凝胶芯的弹簧圈与不带凝胶芯的弹簧圈、带纤维毛的弹簧圈与不带纤维毛的弹簧圈宜划分为不同的注册单元。
(3)空间结构:二维弹簧圈(如螺旋形弹簧圈)与三维弹簧圈(如球形弹簧圈、钻石形弹簧圈等)可划分为同一注册单元。
2、注册申报资料中综述资料包括哪些?
1.器械及操作原理描述
2.产品的适用范围、适用人群、禁忌证
3.包装说明
4.参考的同类产品或前代产品的情况
3、注册申报资料中非临床资料包括哪些?
1.产品技术要求
2.产品检验报告
3.产品性能研究
4.生物学特性研究
5.灭菌工艺研究
6.临床前动物试验
7.稳定性研究
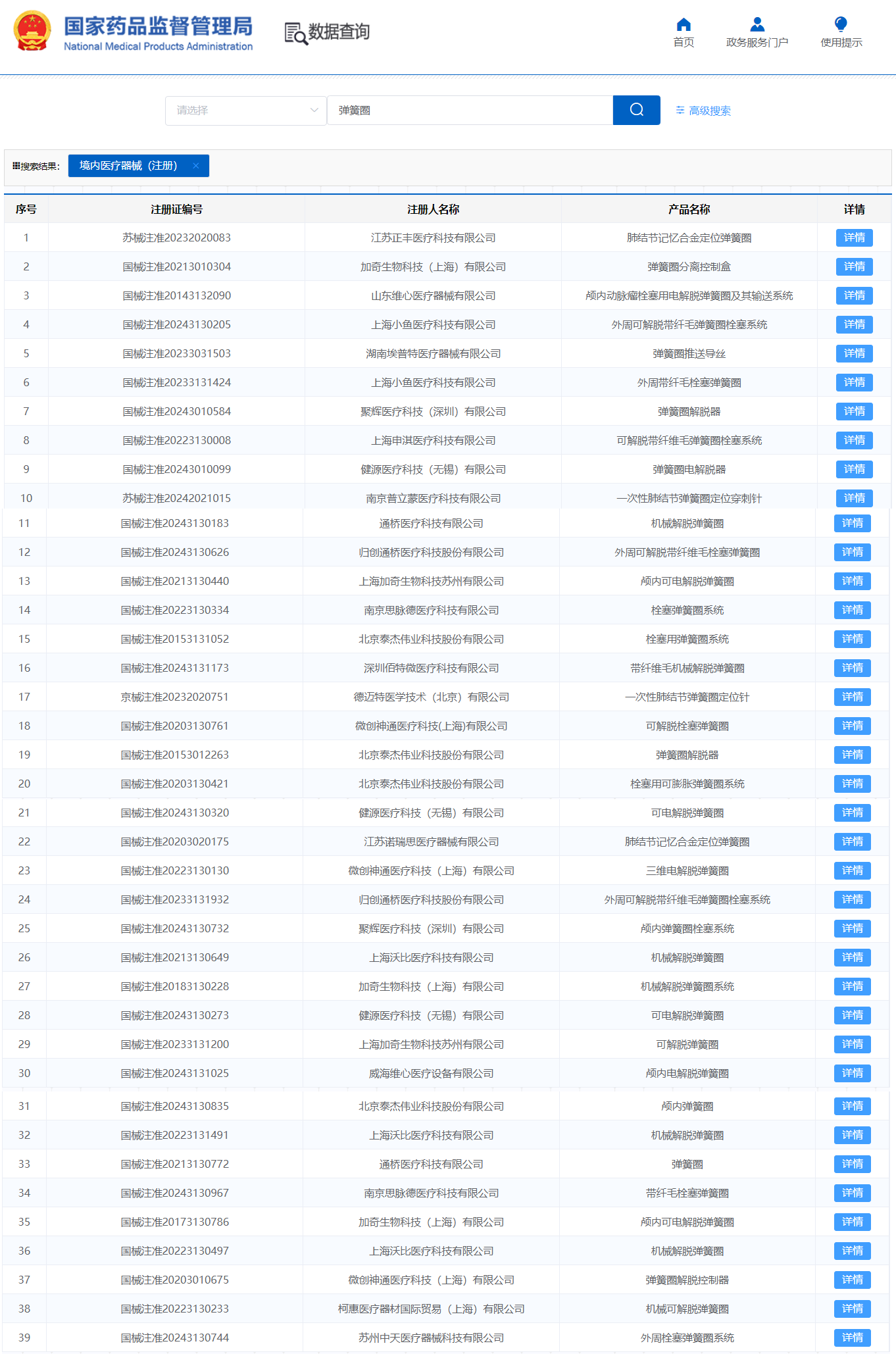
国内已获批的弹簧圈产品(含外周)