
引言
领域前研系列「外科超声刀」 ——临床应用、市场概况、政策法规、注册申报、获批情况汇总 🌈奥泰康已助力多款产品获批前言
能量外科器械,指医生在外科手术过程中,利用各种能量设备对人体组织的切割、游离、凝血、闭合的器械。随着近年来手术需求不断增长及外科手术向微创化、标准化发展,能量外科器械市场不断推陈出新,已成为外科手术中不可或缺的工具,高频电刀、超声刀、等离子刀、微波刀等多种器械接连出现,广泛应用于临床外科手术,在我国能量器械市场中,超声刀占比较高。本文将对超声止血刀这一类器械从临床应用、市场概况、政策法规、注册申报、获批情况等方面进行汇总。
超声刀:微创手术中的常用神器

超声刀这一医疗领域的创新工具,自20世纪50年代诞生以来,便以其独特的优势逐步在医疗界崭露头角。尤其是在上世纪80年代后,随着技术的不断成熟与应用的广泛拓展,超声刀逐步成为外科手术中的重要利器。
手术超声刀利用高强度聚焦超声技术,能精准地在体内切割组织并同时实现良好的止血效果,其工作原理涉及将电能转换为超声波振动,使刀头产生高速微振,这一过程不仅能够切割组织,还能通过摩擦生热实现凝血,减少手术出血,非常适合在需要精细操作的手术环境中使用。此外,超声刀还具有非热效应,能在切割的同时保护周围的健康组织不受损伤,对周边组织的热影响较小。近年来,超声刀被广泛用于外科腹腔镜、胸腔镜手术及开放性手术,肝胆外科、胃肠外科、泌尿外科、神经外科、妇科等多个科室。
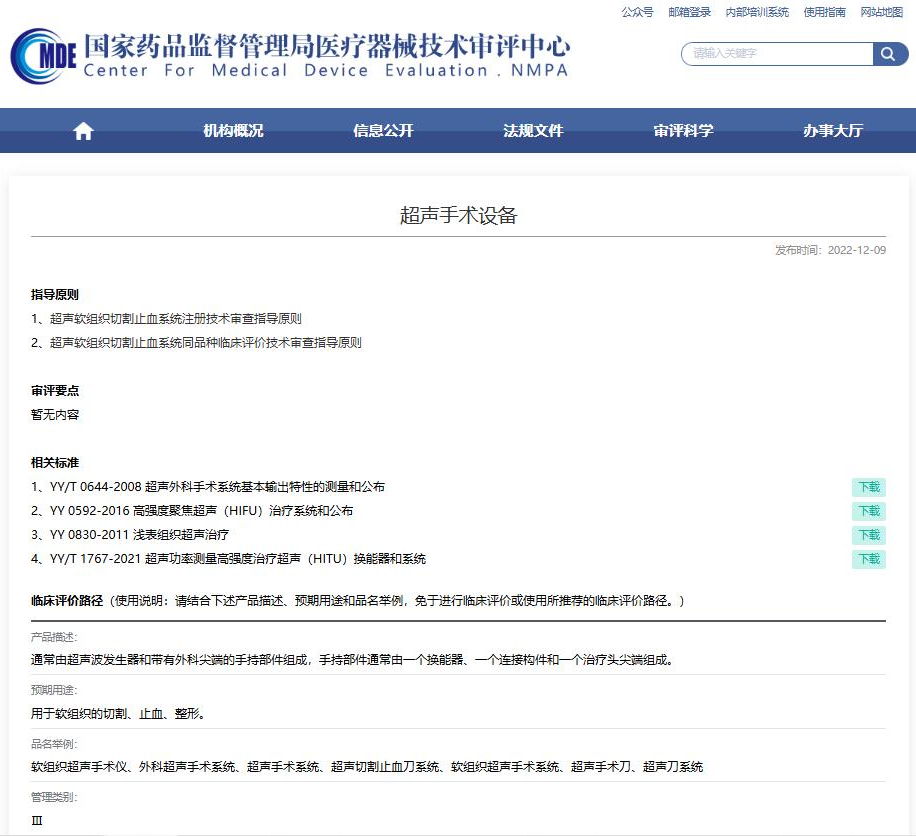 △图片来源:国家药监局器审中心
△图片来源:国家药监局器审中心
市场概况
蛋壳研究院2023年发布的《中国能量外科器械报告》指出,超声刀头按照功能属性被分为不同的组别,分别为3mm、5mm和7mm,目前市场上能够满足‘大血管’(≤7mm)的封闭刀头的超声刀头的企业屈指可数。血管闭合直径参数是超声刀临床优越使用性能和安全性能的一个重要指标。
尽管超声刀有很好的止血效果,但它主要依靠压力和对组织施加能量来压闭血管,血管会在与刀头接触面不出血的情况下封闭止血。闭合的血管直径加大,意味着超声刀需要相应地提高振动频率,提升切割性能、止血性等。部分企业通过改善超声刀头结构设计,增加有效闭合直径。2020年以前,绝大多数国产超声刀可闭合的血管直径都不超过3mm,没有成熟的可闭合5mm、7mm血管的超声刀。 如今,这一技术壁垒已逐渐被国内企业突破。

●2020年8月,以诺康超声刀设备获得国家药监局批准,可用于闭合直径不大于5mm的血管。
●2020年9月,赛诺微医疗的SoniCure超声刀系统获CE公告机构BSI公司批准,可闭合直径不超过7mm的血管。
● 2024年8月,赛诺微医疗科技自主研发的一次性使用超声高频外科集成手术设备超声刀头产品获得NMPA批准上市,系中国第一把获批上市的国产7mm超声刀。
研发企业
健新医疗、锐诺医疗、康基医疗、瑞奇外科、安速康、厚凯医疗、贝恩外科、赛诺微、以诺康、逸思医疗、水木天蓬、速迈医疗、贝恩外科、瀚德微创等。
奥泰康相关项目经验(部分)
近些年,国家鼓励医疗器械自主创新、攻克关键“卡脖子”技术,在国内企业的不断努力下,超声刀闭合血管直径从3mm增长到7mm,从台式到无主机式,从台式到无绳,不断迭代升级,国产替代进程加速。奥泰康也负责了多款超声刀产品的临床服务,助力多款产品获得国家药监局批准上市。
【MA成果展示】以诺康超声刀突破常规临床应用批准上市,奥泰康担任临床试验及注册顾问
里程碑 | 中国第一把获批上市的国产7mm超声刀,赛诺微造!
 △超声刀术中操作示意图
△超声刀术中操作示意图
注册申报部分执行难点/关键点(同品种)
01
确定同品种医疗器械
根据申报产品的技术特征和适用范围,筛选出合适的同品种医疗器械。注册申请人可选择一种或多种对比器械,建议选取工作原理和作用机理尽可能相同的产品作为对比器械。如果选择多个对比器械,可选择最相近的对比器械进行主要比对。对每一个对比器械给出选择说明,并证明各对比器械的不同特征和功能整合到一台器械上后不会引起新的安全性和有效性的问题。
02
收集对比资料
包括同品种医疗器械的临床数据、技术文件、使用说明书、不良事件等信息,这些资料将作为比对分析的基础,因此需要确保其全面、精准、具有可重复性。同品种医疗器械临床数据的收集需考虑实际闭合效果、可处理血管尺寸、术后愈合、术中出血、不良事件(需着重关注侧向热损伤和术后出血)等情况,需能证实其在真实世界中临床应用情况。
03
详细对比分析
按照《医疗器械临床评价技术指导原则》的要求,对申报产品与同品种产品在基本原理、适用范围及临床使用相关信息的对比,结构组成、性能要求、软件核心功能、安全性评价等技术特征方面的对比,以及生物学特性方面进行逐项对比,确保两者在关键指标上基本一致。详细列出申报产品与同品种产品的差异点,并论证这些差异点是否对申报产品的安全、有效产生不利影响。
*了解更多此类产品申报要点可添加文末企业微信
政策法规

●医疗器械产品分类界定汇总结果中,国家药品监督管理局建议超声高频外科集成手术系统用刀头按照第三类医疗器械管理的产品管理。
●2021年11月25日,国家药监局制定了超声软组织切割止血系统同品种临床评价技术审查指导原则,指出可闭合血管的超声软组织切割止血系统(尺寸通常包括3mm、5mm和7mm)可采取同品种临床评价。(附件:超声软组织切割止血系统同品种临床评价技术审查指导原则)
●2023年3月31日,国家药监局器审中心修订发布了《超声软组织手术设备注册审查指导原则》(2023年修订版)。(附件:超声软组织手术设备注册审查指导原则(2023年修订版)
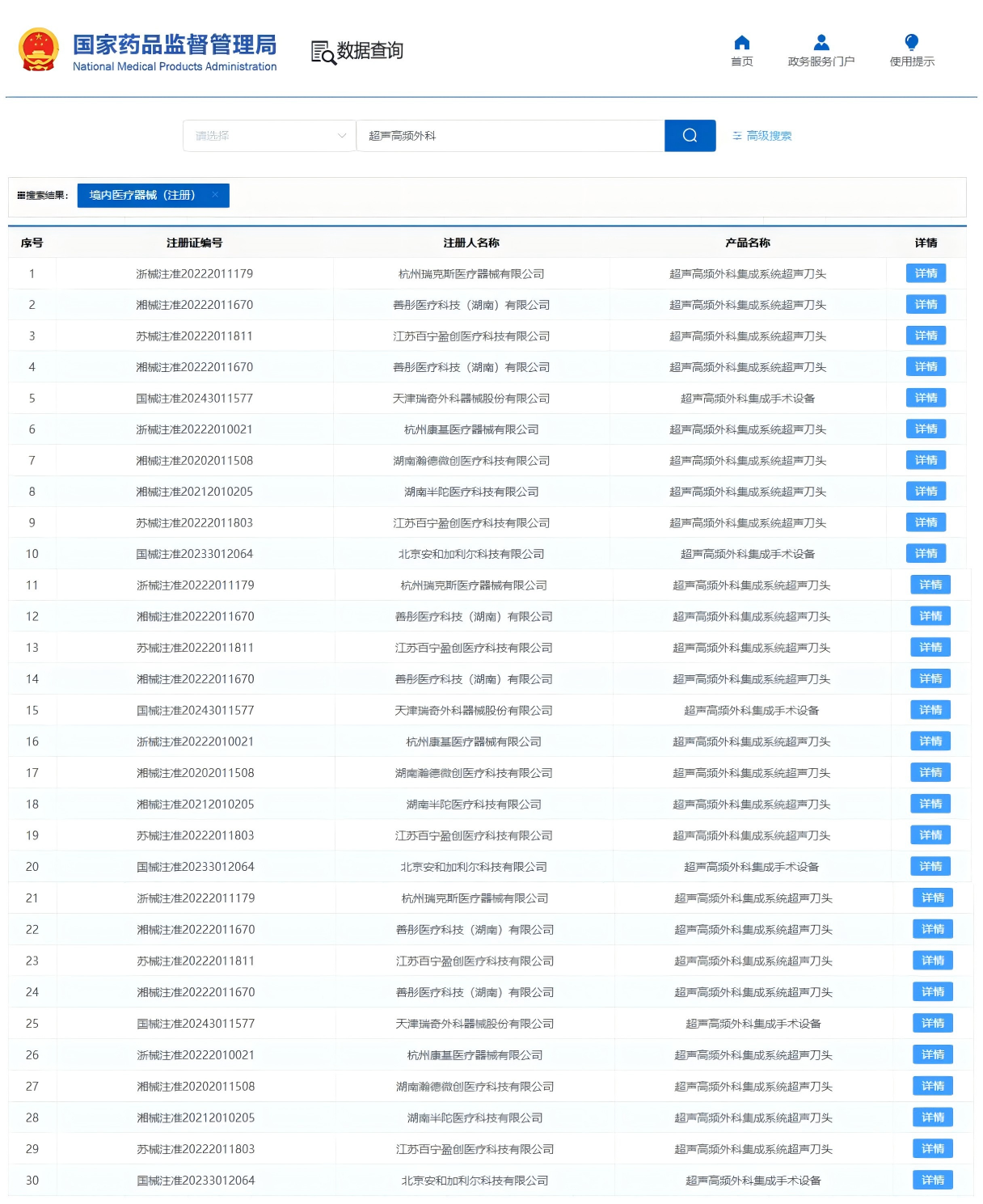
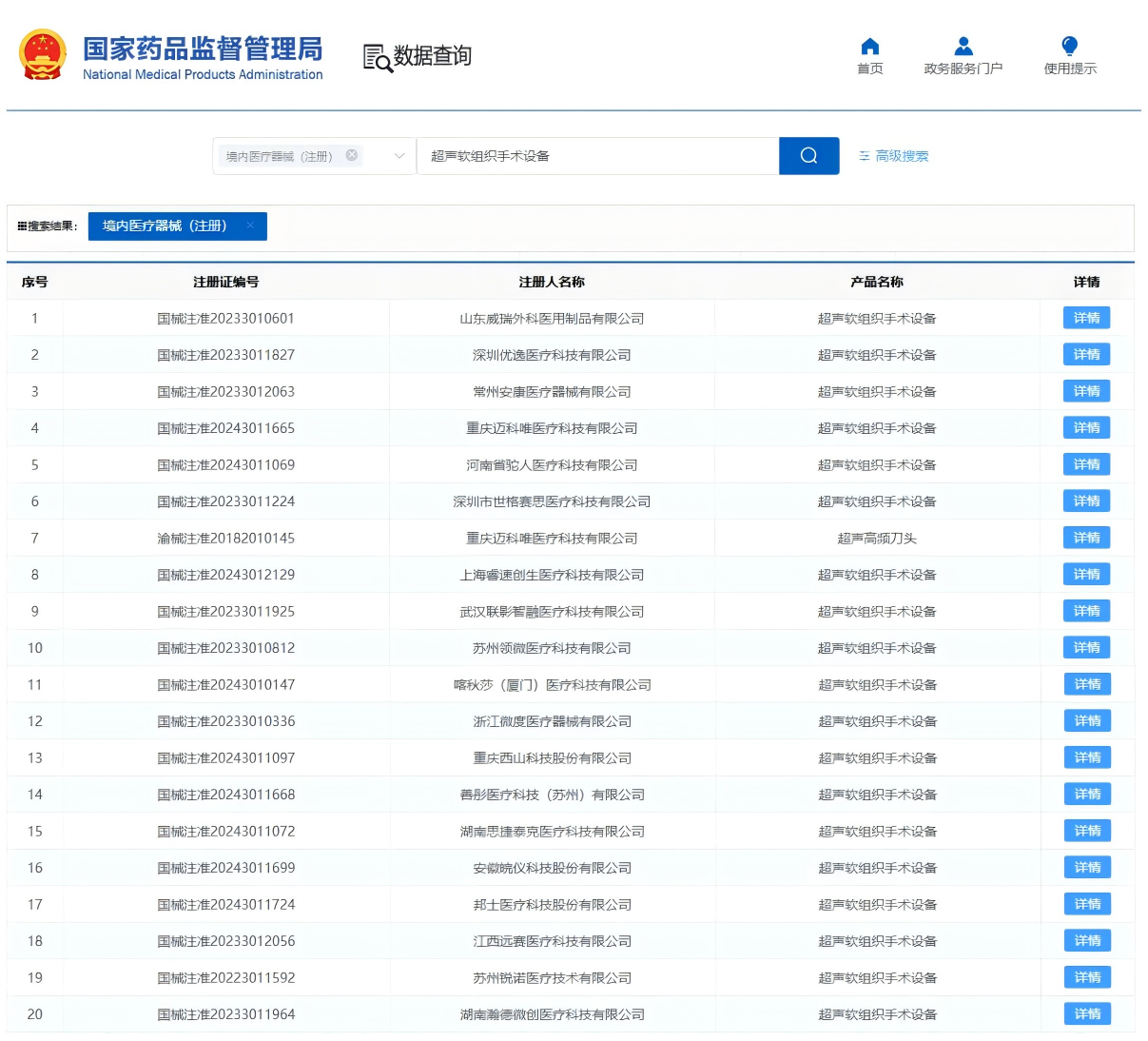
国内已获NMPA批准的超声刀产品
(不完全统计)
未来可期,拭目以待
我国超声刀市场正迅速扩展,受政策鼓励与企业创新推动,政策助力与市场需求双轮驱动下,国产超声刀品牌崛起势不可挡,未来将更多应用于临床,助力我国医疗技术进步与产业升级,奥泰康也将持续关注这一临床应用领域。