由北京博辉瑞进生物科技有限公司研制生产,北京奥泰康医药技术开发有限公司担任CRO合同研究组织机构申请的三类医疗器械肛瘘塞产品,于2019年11月11日经国家药品监督管理局(NMPA)批准,取得了上市注册批件,批准文号为:国械注准20193130872,肛瘘塞主要用于肛瘘及软组织缺损修复及增强。

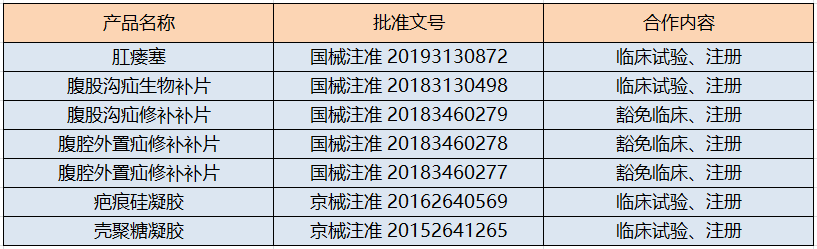
该项目是奥泰康集团与博辉瑞进合作取得的第七个临床试验和注册成果,双方通过多年的密切合作,奥泰康集团先后协助博辉瑞进完成七个产品上市准许,成果如下:
肛瘘塞由北京博辉瑞进生物科技有限公司研制生产,北京奥泰康医药技术开发有限公司负责提供产品在检测、动物试验、临床试验及注册环节的市场准入MA全流程解决方案支持。该项目为新版《医疗器械注册证管理办法》(2014年10月1日)和《医疗器械临床试验质量管理规范》(2016年6月1日)颁布近3年来国家药品监督管理局依据最新法规政策《动物源性医疗器械注册技术审查指导原则》唯一批准的以脱细胞处理的猪小肠黏膜下层组织(SIS)组成的国产肛瘘塞。从项目特性来看,该项目难度大、专业性强、高风险、高投入。北京博辉瑞进生物科技有限公司与北京奥泰康医药技术开发有限公司的项目团队通过紧密合作共同克服各种技术难题,顺利实现了从研发至产品上市的转化。
为了保证动物源性产品的安全性,严格控制动物源病毒和传染性因子的风险因素,项目团队在原材料的收集、保存、处置、贮存和运输等方面进行了全方位风险控制,制定了非常严格的操作规范,确保了这些过程的可追溯性和合规性,实现了产品的原材料来源的全程受控。为了进一步控制产品的安全性,项目团队在生产工艺中设置了病毒灭活/去除的相关步骤,充分考虑了病毒灭活的相关处理步骤对医疗器械产品性能的影响并进行了病毒灭活的相关验证工作。为降低动物源性材料的免疫原性风险,项目团队在生产工艺中采取相应处理措施以降低其免疫原性,并对其降低材料免疫原性的有效性进行验证,如对残留细胞、残留DNA、残留α-Gal抗原的数量进行控制。免疫原性报告采用的方法结合GB/T 16886.20进行,在免疫原性报告中清晰的阐述了选择动物模型的理由,对结果进行了全面的分析。该产品是动物源生物再生材料,是基于自主研发的再生性细胞外基质源材料(SIS)而开发的,属高风险产品。尽管目前市场上存在同类进口产品,但因其材料来源、取材部位、生产工艺、加工助剂存在差异,项目团队严格按照最新的动物实验指导原则进行方案设计、模型建立和数量选择。动物实验结果表明该产品安全有效质量可控,为顺利进入临床试验提供了保证。考虑到动物源性产品通常为可降解产品,降解周期会影响产品的有效性,降解产物则对产品安全性产生重大影响,因此这类产品需要进行降解性能的研究。项目团队开展了体外降解和体内降解两部分研究,对降解产物进行分析,并进行了全面细致的降解研究生成了完整的研究报告记录,符合注册指导原则的要求。该产品属于可降解的植入类医疗器械,在临床试验前进行了系统的生物学评价试验,包括细胞毒性,迟发型超敏反应、皮内刺激,急毒,遗传毒性,植入等,检测结果表明符合要求,为了进一步评估产品的安全性和有效性,在完成动物实验后项目团队组织开展了前瞻性多中心随机开放对照试验,对照采用了全球公认的COOK公司同类产品进行非劣效试验,试验结果表明北京博辉瑞进生物科技有限公司肛瘘塞有效性和安全性方面和美国COOK公司产品一致。


