
引言
奥泰康助力医工结合创新转化产品「一体式人工血管术中支架系统」获批——开启A型主动脉夹层治疗新纪元2025年4月9日,由北京华脉泰科医疗器械股份有限公司和中国医学科学院阜外医院于存涛教授合作研发的创新产品【一体式人工血管术中支架系统】通过国家药品监督管理局(NMPA)注册审核,获得第三类医疗器械注册证(国械注准20253130730)。奥泰康依托MA市场准入全流程解决方案助力产品上市。
市场准入全流程服务,为医疗成果落地赋能
将一个临床需求转化为医疗器械产品并最终获批上市受益临床,是一个涉及多学科协作、多方协同、严格执行SOP流程和法规监管的复杂过程。产品的获批不仅意味着这项医工结合的技术获得业界认可,同时也充分展现了奥泰康在创新及高端医疗器械CRO服务领域的卓越实力和专业承诺,再一次实现了创新三类高风险植入类器械服务领域的里程碑式跨越。在此次合作中,奥泰康发挥其在临床注册服务领域的优势,为该医疗器械项目配备了专业的临床执行团队,严格遵循国家相关法规和标准执行,确保试验数据的科学性、准确性和可靠性。

△临床试验方案讨论会现场
项目在疫情期间开展,临床试验方面,执行团队面临参研中心无法提供人员跟台,执行团队随时面临疫情封控的风险,以及受试者入院入组和正常随访的挑战,通过多方高效协作,最大限度保障临床试验进度不受影响。
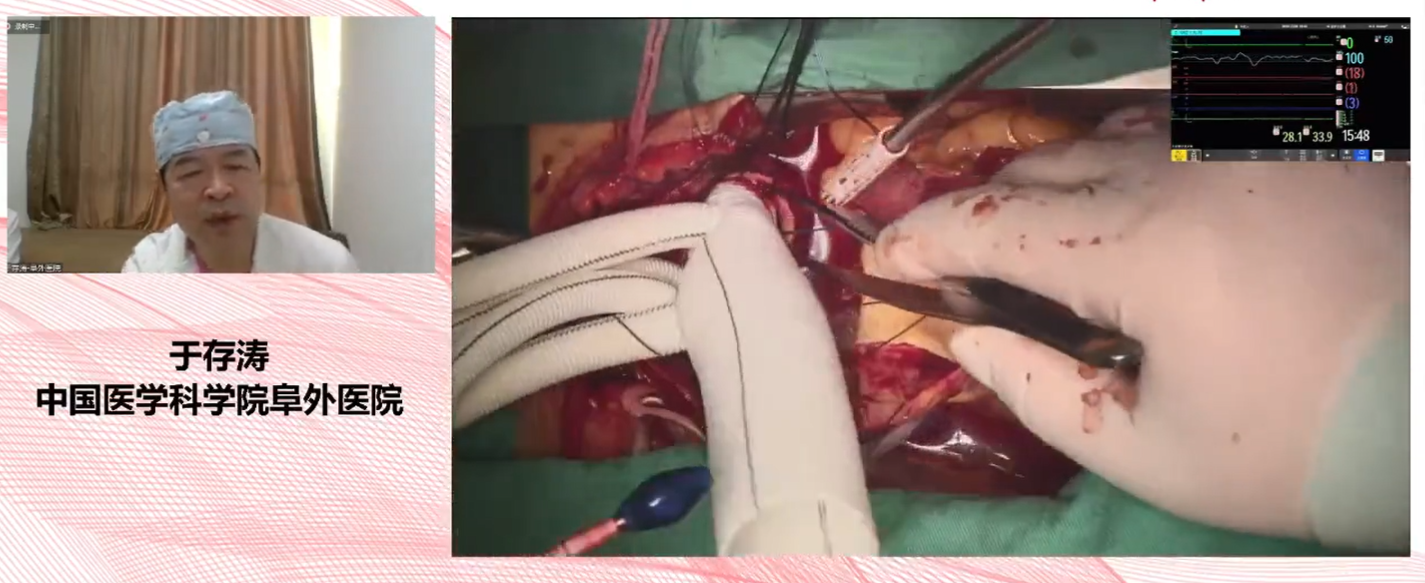
△于存涛教授手术教学指导现场
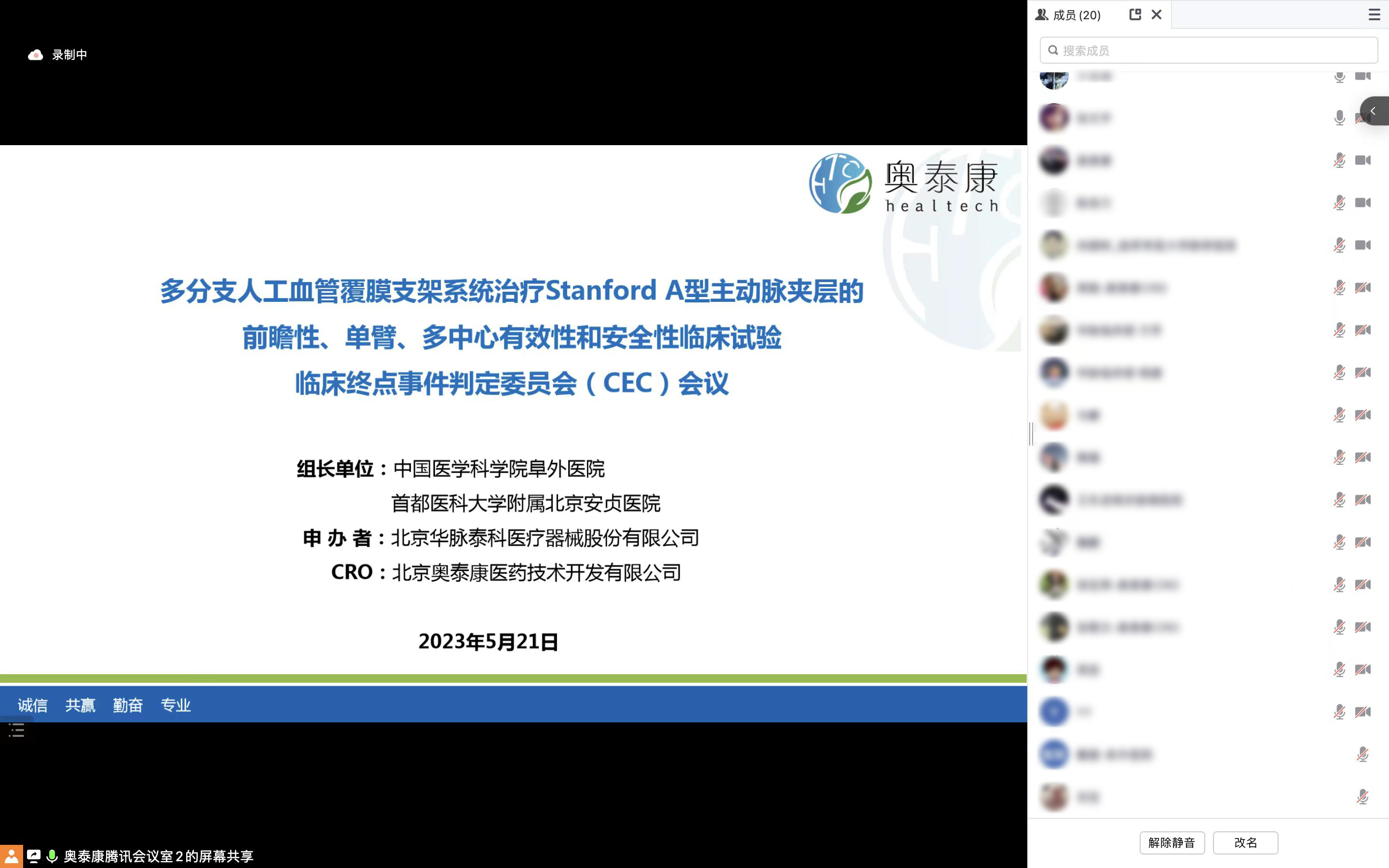
△临床终点事件判定委员会(CEC)线上会议
奥泰康团队从产品创新申报、临床试验、CEC审评会议、注册发补咨询、产品风险获益分析等环节助力产品上市。
获批时间轴
01
2019年10月
探索性试验首例受试者入组
02
2019年11月
临床试验方案讨论会
03
2020年4月
召开创新审查答辩会
通过创新审批
04
2020年8月
FIM试验第一例受试者入组
05
2022年6月
最后一例受试者入组
06
2023年5月
召开临床终点事件判定委员会(CEC)会议
07
2024年1月
提交产品注册申请
08
2025年4月
产品获国家药监局批准上市
携手并进·再创辉煌
全球首创的创新医疗器械华脉·心岸®一体式人工血管术中支架系统,自中国医学科学院阜外医院于存涛教授2008年提出产品概念到产品研发直至上市,历经十余年,标志着我国在主动脉疾病治疗领域取得重大突破,是医工结合科研成果转化的成功案例,也是奥泰康在创新及高端医疗器械全流程解决方案实力的又一次彰显。衷心祝贺我们的客户企业取得国家药监局评审许可,也感谢参研中心及合作伙伴的全程支持与配合,我们也将以此为契机,始终坚持服务质量的底线,期待未来奥泰康能够推动更多优质产品进入市场。
