
引言
国产崛起,填补空白 1月两款ECMO获批, 危重患者的“终极武器” 从研发到临床 ——多维度还原救命神器 期待国产技术迎来更多高光时刻引言
“2023年1月,国家药监局应急批准汉诺医疗(1.4日)和长征医疗(1.17日)的ECMO产品(体外肺/心肺支持辅助设备)上市,系国内首款和第二款获批的国产ECMO设备,填补了国内空白。”
体外膜肺氧合
Extracorporeal Membrane Oxygenation,ECMO
又称“人工肺、叶克膜”,一种重要的体外生命支持技术,将患者的部分静脉血从体内引到体外,经膜肺氧合后再由驱动泵将血液回输体内,对严重循环、呼吸衰竭的病人进行有效支持,主要用于心脏功能不全、呼吸功能不全的支持,被誉为ICU里把守“生死之门”的最后一道防线,抢救新冠肺炎危重病人的“终极武器”,ECMO作为常规治疗无效的危重型新冠肺炎患者的挽救性治疗设备,是《新型冠状病毒肺炎诊疗方案》中明确的治疗措施,但受制于研发难、生产难、技术门槛高、临床使用制约等多因素限制,国产企业无ECMO设备获批上市,我国ECMO严重依赖进口,主要被美敦力(Medtronic)、理诺珐(LivaNova)和迈维柯(Maquet)三家垄断。
ECMO的临床落地
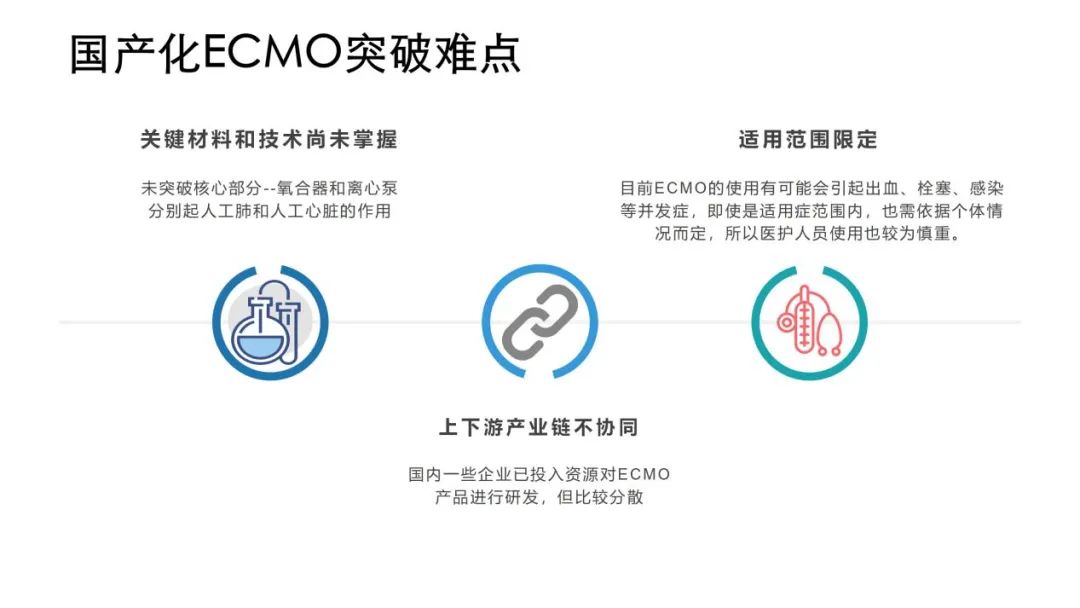 离心泵和膜肺是ECMO的两大核心构件,分别起到人工心脏和人工肺的作用,是最具技术研发难度的部分,也是当前ECMO国产化的难点。而临床试验的难点在于试验方案设计面临无从参考的困难,国内尚无ECMO审批的技术指导原则,且此前没有获批的产品,故没有临床试验的经验可供借鉴。目前公开数据查询到的临床试验方案设计有“前瞻性、多中心、随机、单盲、阳性平行对照”及“前瞻性、多中心、单组目标值”两种,试验一般在医院的重症监护室(ICU)入组受试者,根据在阜外医院开展的一项临床试验方案显示,方案要求入组28例患者,存活率达50%以上。
离心泵和膜肺是ECMO的两大核心构件,分别起到人工心脏和人工肺的作用,是最具技术研发难度的部分,也是当前ECMO国产化的难点。而临床试验的难点在于试验方案设计面临无从参考的困难,国内尚无ECMO审批的技术指导原则,且此前没有获批的产品,故没有临床试验的经验可供借鉴。目前公开数据查询到的临床试验方案设计有“前瞻性、多中心、随机、单盲、阳性平行对照”及“前瞻性、多中心、单组目标值”两种,试验一般在医院的重症监护室(ICU)入组受试者,根据在阜外医院开展的一项临床试验方案显示,方案要求入组28例患者,存活率达50%以上。
国内ECMO产品研发进度
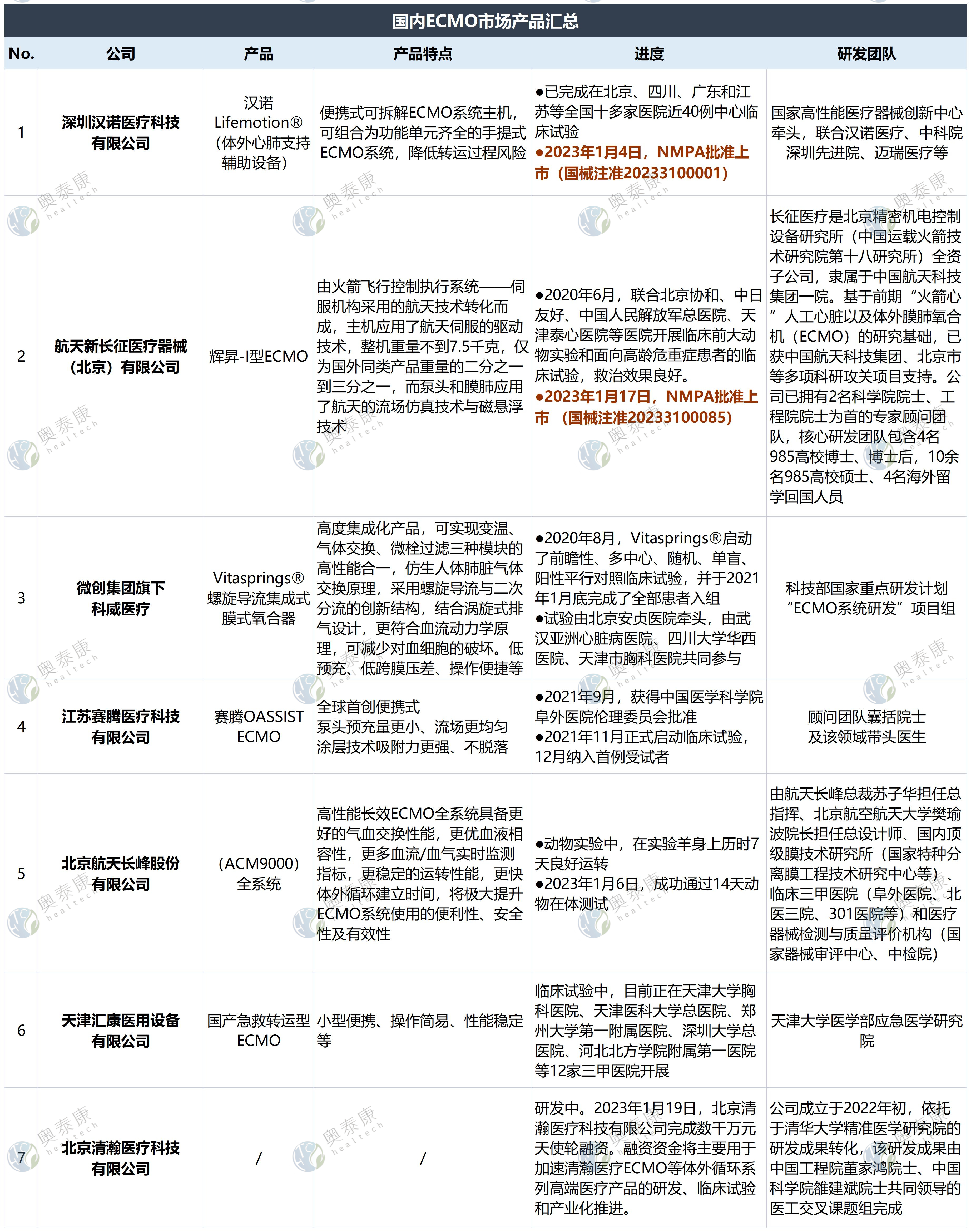
国内研发企业少,产品大多在临床试验进程中
数据来源:公开资料
主要研发企业
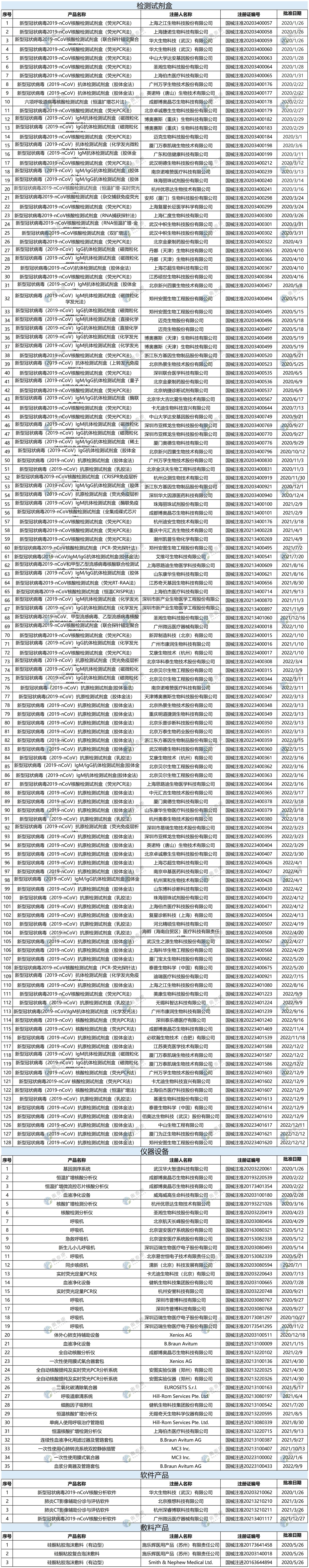
 何为应急审批?
何为应急审批?
两款ECMO均为应急批准,应急审批是指当社会存在突发公共卫生事件威胁以及突发公共卫生事件发生时,为有效预防、及时控制和消除突发公共卫生事件危害,确保应急所需医疗器械能够尽快完成注册审批的程序。在产品注册申报过程中,国家药监局按照“统一指挥、早期介入、快速高效、科学审批”的原则,成立应急审评工作组,专人负责、全程指导、发布技术审查指导原则,加大产品注册申报指导,加快审评审批进程,在保证安全、有效的基础上推动产品尽快上市。截至2022年12月22日CMDE统计,自2020年1月以来,已有170个产品经应急审批上市。
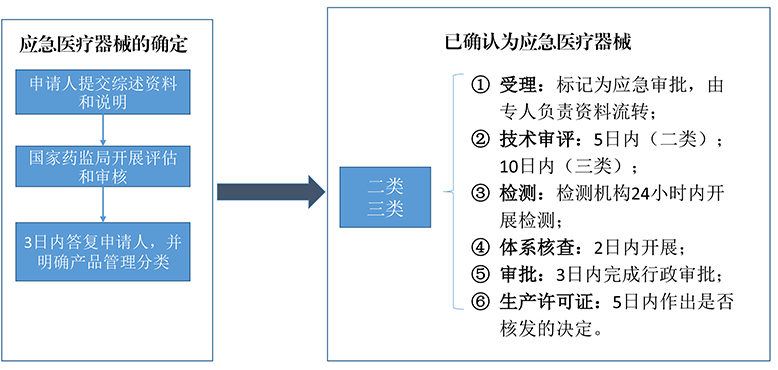
应急审批流程(图源:CMDE)
专家共识&指导原则
为提高救治有效性,临床专家撰写多个专家共识,国家出台相应指导原则和法规,对ECMO技术的使用规范起到指导作用。
●《成人体外膜氧合循环辅助专家共识》2018版
●《新生儿呼吸衰竭体外膜肺氧合支持专家共识》
●《成人体外膜肺氧合患者院际转运专家共识》
●《不同情况下成人体外膜肺氧合临床应用专家共识》2020版
●《新型冠状病毒肺炎体外膜肺氧合支持治疗专家共识》
●《国家限制类技术临床应用管理规范》2022年版
●《国家药监局体外膜氧合(ECMO)循环套包-注册审查指导原则》
●《新型冠状病毒感染诊疗方案(试行第十版)》
热点赛道,蓄势待发
国产技术的崛起令人欣喜,相较发达国家,我国ECMO市场潜力巨大,临床、科研、政策、资本等多方关注也证实了ECMO赛道的火热,期待国产化进程的加速落地,为临床危重症患者带来更多诊疗选择,我们也将持续关注医疗行业前沿动向。
- END -
公众号 : 奥泰康
微信号:Aotaikang2006
添加微信可获取文中源文件
【关于我们】
奥泰康成立于2006年,为生物医药行业提供CRO&CDMO一体化服务。公司致力成为医药行业MA解决方案领导者,为健康事业持续创造新的价值。集团通过提供时效性强、成本可控、质量有保障和专业性的研究开发、产品检测、动物实验、临床试验和产品注册全程解决方案,持续推动安全、有效和质量可控的产品进入市场,保障人类生命健康。
地址:北京市丰台区南四环西路186号汉威国际广场二区2号楼7层
电话:400-080-9519;010-83739181
邮箱:services@healtech.com.cn
网址:http://www.healtech.com.cn