
引言
新年特辑 | 奥泰康2023年终盘点日迈月征,朝暮轮转
2023 渐行渐远
2024 悄然而至
过去一年
在日新月异的变革中
我们一同亲历了医疗行业的高速发展
与合作伙伴分享市场准入的喜悦
感恩大家一路的支持与陪伴
是团队的力量推动每一个项目落地
最终见证了里程碑的达成
让我们跟随时间
共同回顾2023年一起走过的精彩旅程
1月
脊髓刺激系统-首例植入
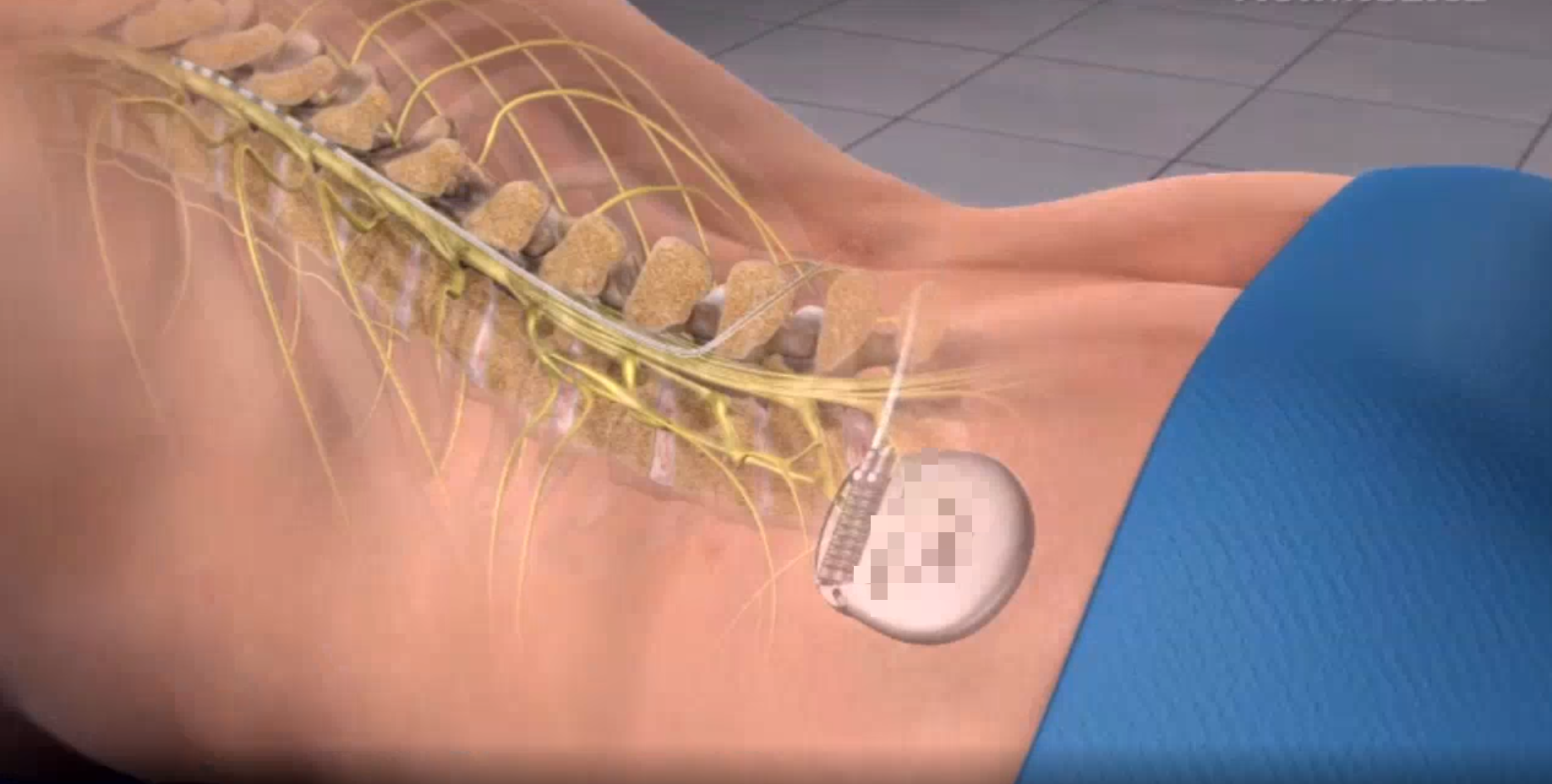 1月,脊髓刺激系统(SCS)临床试验在浙医一院疼痛科顺利完成首例临床植入,产品用于慢性疼痛,临床验证工作将为产品未来在中国上市提供更全面的临床依据.
1月,脊髓刺激系统(SCS)临床试验在浙医一院疼痛科顺利完成首例临床植入,产品用于慢性疼痛,临床验证工作将为产品未来在中国上市提供更全面的临床依据.
2月
助力冠脉产品获证

2月,药物涂层PTCA球囊扩张导管(国械注准20233030115)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的首张三类医疗器械注册证。
富春山会议-发表演讲
 2月,富春山•中国医药生物技术行业年度报告会暨2022年中国医药生物技术十大进展发布会召开,奥泰康应邀出席会议,围绕《再生医学生物材料引导组织修复器官再造的应用和创新》发表主题报告。
2月,富春山•中国医药生物技术行业年度报告会暨2022年中国医药生物技术十大进展发布会召开,奥泰康应邀出席会议,围绕《再生医学生物材料引导组织修复器官再造的应用和创新》发表主题报告。
眼科创新产品-全球首例植入
 2月,植入式眼部肌肉神经刺激器i-NYS,在首都医科大学附属北京朝阳医院完成全球首例植入,产品系全球首创且唯一用于治疗先天性眼球震颤的三类有源植入式医疗器械,有望彻底破解眼球震颤的治疗难题。
2月,植入式眼部肌肉神经刺激器i-NYS,在首都医科大学附属北京朝阳医院完成全球首例植入,产品系全球首创且唯一用于治疗先天性眼球震颤的三类有源植入式医疗器械,有望彻底破解眼球震颤的治疗难题。
3月
介入二尖瓣腱索修复系统-临床试验启动

3月,介入二尖瓣腱索修复系统临床试验正式启动,并完成全国首例临床应用,手术的圆满完成让团队突破了外科手术局限,为试验的进一步开展奠定信心和经验基础,全国多中心临床试验患者入组正式开始。
CIMDR-出席并发表演讲
 3月,第十三届中国医疗器械监督管理国际会议(CIMDR)落幕,奥泰康应邀出席会议,并在医疗器械创新分会中以《创新医疗器械研发设计与注册》为主题进行分享,为医疗器械从业者带来满满干货,吸引众多业内医疗同仁切磋交流.
3月,第十三届中国医疗器械监督管理国际会议(CIMDR)落幕,奥泰康应邀出席会议,并在医疗器械创新分会中以《创新医疗器械研发设计与注册》为主题进行分享,为医疗器械从业者带来满满干货,吸引众多业内医疗同仁切磋交流.
助力心血管产品获证
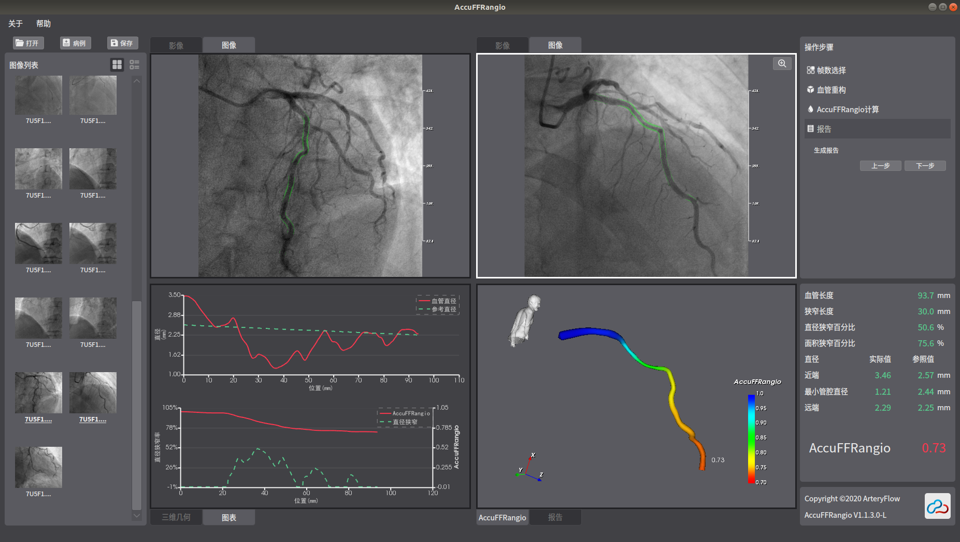 3月,冠脉造影血流储备分数计算设备(国械注准20233070251)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第五张三类医疗器械注册证。
3月,冠脉造影血流储备分数计算设备(国械注准20233070251)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第五张三类医疗器械注册证。
苏州CDMO入围吴中区合同成交额十强
 3月,奥泰康苏州CDMO中心——苏州苏豪生物材料科技有限公司获得吴中区2022年度技术合同成交额十强企业荣誉,未来奥泰康苏州CDMO中心将立足再生医学生物材料更好地发挥示范引领作用,持续推动安全、有效和质量可控的产品进入市场。
3月,奥泰康苏州CDMO中心——苏州苏豪生物材料科技有限公司获得吴中区2022年度技术合同成交额十强企业荣誉,未来奥泰康苏州CDMO中心将立足再生医学生物材料更好地发挥示范引领作用,持续推动安全、有效和质量可控的产品进入市场。
4月
助力FFR软件获证
 4月,冠状动脉CT血流储备分数计算软件(国械注准20233210450)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第六张三类医疗器械注册证。
4月,冠状动脉CT血流储备分数计算软件(国械注准20233210450)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第六张三类医疗器械注册证。
参加动脉网VB100 Mini论坛
 4月,由动脉网、VB100、蛋壳研究院、君联资本等单位主办的2023 VB100 Mini论坛中,奥泰康副总裁王成珍女士应邀出席活动,与众多产业企业、投资机构的嘉宾,就产品从立项、设计、生产到临床上市等全流程的关键要点展开深入探讨。
4月,由动脉网、VB100、蛋壳研究院、君联资本等单位主办的2023 VB100 Mini论坛中,奥泰康副总裁王成珍女士应邀出席活动,与众多产业企业、投资机构的嘉宾,就产品从立项、设计、生产到临床上市等全流程的关键要点展开深入探讨。
助力肺部AI产品获证
 4月,肺结节CT图像辅助检测软件(国械注准20233210530)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第7张三类医疗器械注册证,也是公司累计助力获得的第12张人工智能(AI)医疗器械注册证
4月,肺结节CT图像辅助检测软件(国械注准20233210530)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第7张三类医疗器械注册证,也是公司累计助力获得的第12张人工智能(AI)医疗器械注册证
5月
国内器械CDMO平台首张三类证获批
 5月,奥泰康北京CDMO中心取得国家药监局批准的三类医疗器械注册证(国械注准20233140615),系全国首个以细胞外基质来源的胶原蛋白为原料制备的三类胶原贴敷料,也是器械CRO/CDMO行业受托研发诞生的全国首个三类医疗器械注册证,具有里程碑意义。
5月,奥泰康北京CDMO中心取得国家药监局批准的三类医疗器械注册证(国械注准20233140615),系全国首个以细胞外基质来源的胶原蛋白为原料制备的三类胶原贴敷料,也是器械CRO/CDMO行业受托研发诞生的全国首个三类医疗器械注册证,具有里程碑意义。
助力口腔产品获证
 5月,骨填充材料(国械注准20233170649)获得NMPA批准上市,奥泰康承担本产品临床试验服务,系本年度奥泰康合作项目获得的第9张三类医疗器械注册证。
5月,骨填充材料(国械注准20233170649)获得NMPA批准上市,奥泰康承担本产品临床试验服务,系本年度奥泰康合作项目获得的第9张三类医疗器械注册证。
参加宣武医院GCP培训
 5月,首都医科大学宣武医院发起的“GCP+伦理”培训,奥泰康临床注册部总监受邀参加并围绕器械注册研究分享主题报告。通过临床试验机构、伦理委员会、循证医学中心等各方联动合作,培训进一步提高了研究者临床研究能力,为临床研究项目高质量发展奠定了良好基础。
5月,首都医科大学宣武医院发起的“GCP+伦理”培训,奥泰康临床注册部总监受邀参加并围绕器械注册研究分享主题报告。通过临床试验机构、伦理委员会、循证医学中心等各方联动合作,培训进一步提高了研究者临床研究能力,为临床研究项目高质量发展奠定了良好基础。
TAVR产品完成全部临床入组
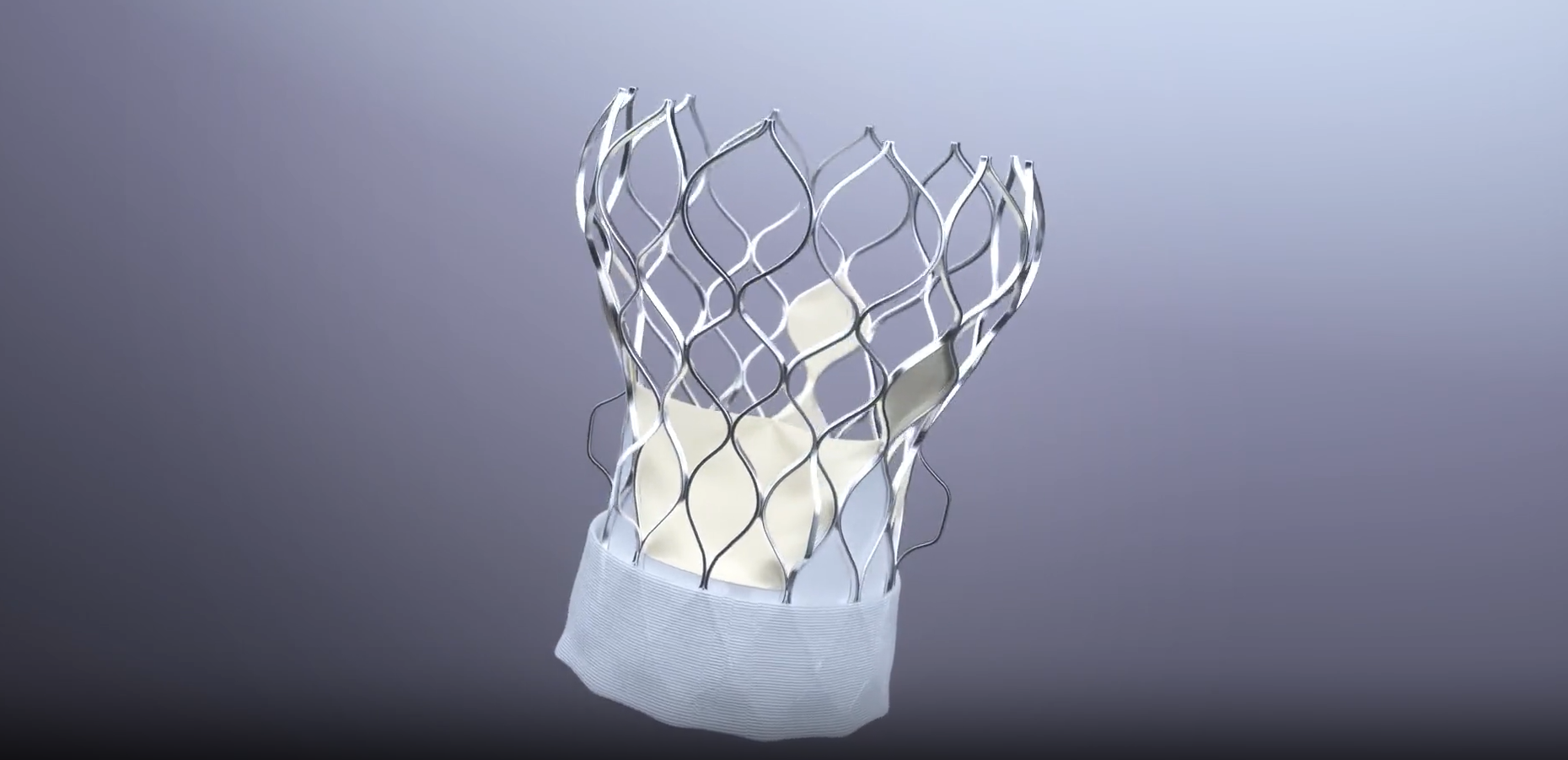 5月,经导管主动脉瓣膜置换产品Xcor™完成全部可行性+确证性临床试验的患者入组,为全球心血管临床医生提供了具有扎实产品设计和临床证据的创新解决方案,为Xcor™瓣膜不远的将来完成产品注册和全国推广迈出了关键的一步。
5月,经导管主动脉瓣膜置换产品Xcor™完成全部可行性+确证性临床试验的患者入组,为全球心血管临床医生提供了具有扎实产品设计和临床证据的创新解决方案,为Xcor™瓣膜不远的将来完成产品注册和全国推广迈出了关键的一步。
应邀出席-中关村论坛

5月,奥泰康应邀出席2023中关村论坛国际技术交易大会,立足创新医疗器械和高端医疗器械,为企业参会代表展示研究开发、产品检测、动物实验、临床试验和产品注册全流程解决方案,围绕CRO&CDMO一体化服务进行答疑和交流,受到与会代表的肯定。
6月
冲击波球囊导管系统-临床首例入组
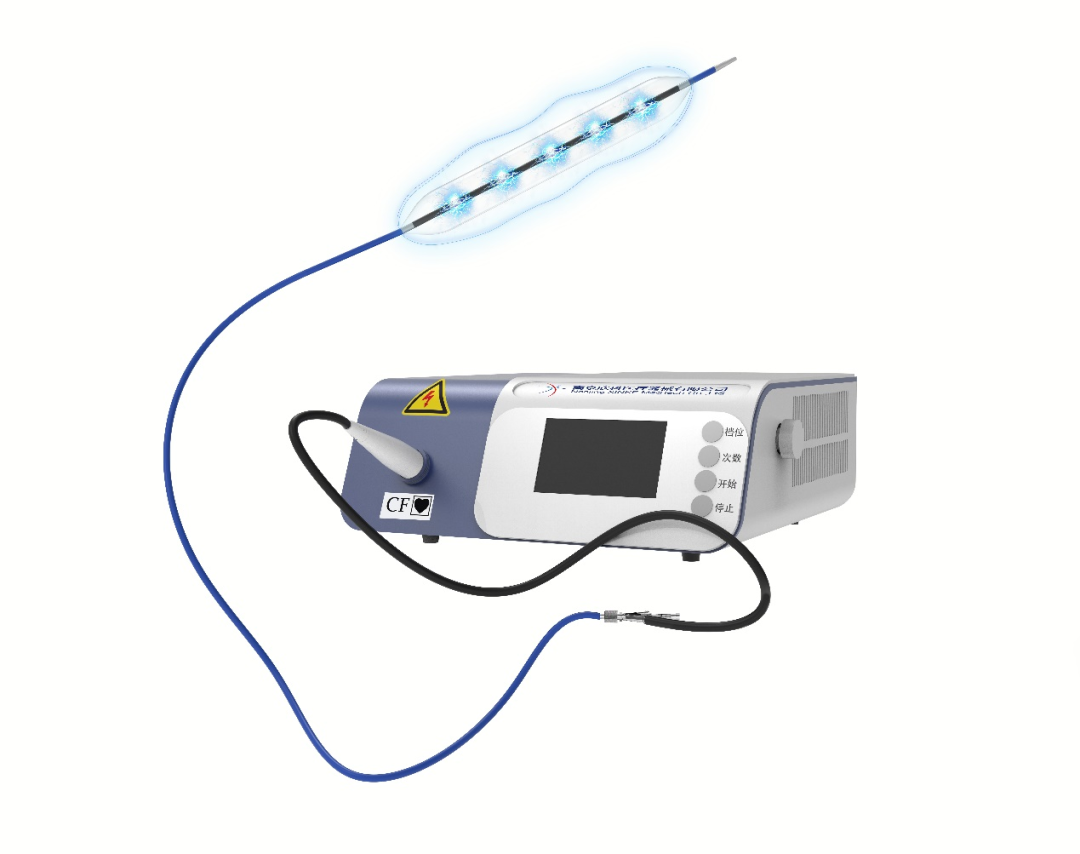 6月,外周血管内冲击波球囊导管系统,上市前临床研究完成首例患者入组,奥泰康负责临床试验服务,期待这一创新器械早日上市,为血管介入医生提供新的钙化病变治疗选择,造福广大下肢动脉闭塞症患者。
6月,外周血管内冲击波球囊导管系统,上市前临床研究完成首例患者入组,奥泰康负责临床试验服务,期待这一创新器械早日上市,为血管介入医生提供新的钙化病变治疗选择,造福广大下肢动脉闭塞症患者。
植发机器人-临床试验启动会
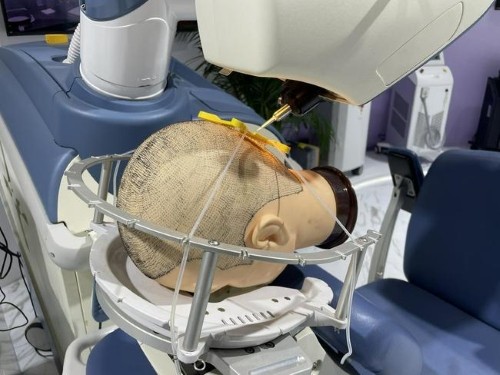
6月,植发机器人临床试验召开项目启动会,参会专家对这一创新产品给予高度肯定,奥泰康作为临床试验服务方,也期待这一款产品今后能对国内植发行业带来里程碑式升级。
通过创新型中小企业认定
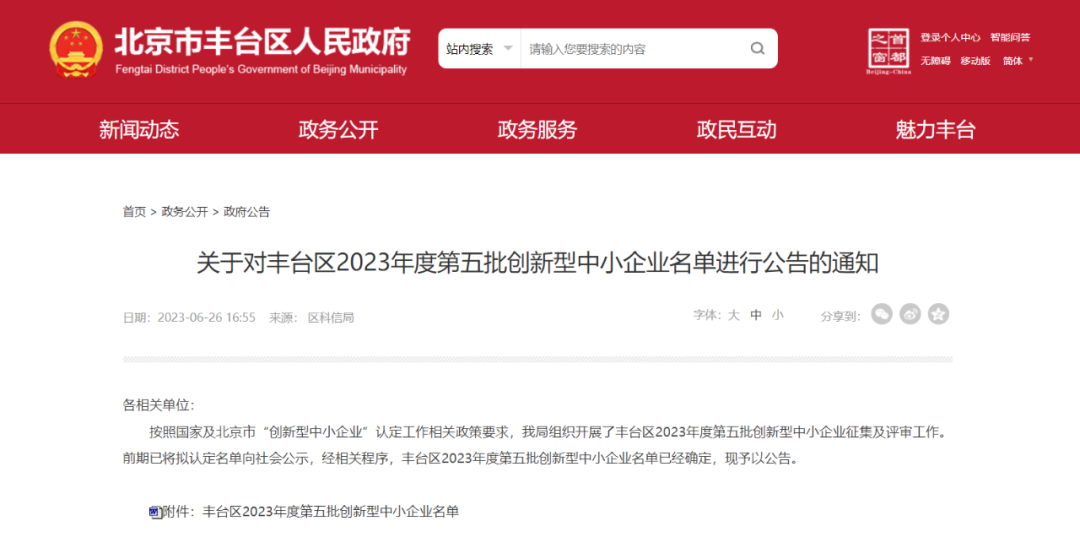 6月,奥泰康入选丰台区2023年度第五批创新型中小企业名单,创新型中小企业的认定是国家根据企业创新能力、成长性、专业化三类指标评出,创新型中小企业一般包括技术创新、管理创新、市场敏感度、快速发展、贡献就业、推动经济等特点。
6月,奥泰康入选丰台区2023年度第五批创新型中小企业名单,创新型中小企业的认定是国家根据企业创新能力、成长性、专业化三类指标评出,创新型中小企业一般包括技术创新、管理创新、市场敏感度、快速发展、贡献就业、推动经济等特点。
7月
恩施州领导莅临考察
 7月,恩施州州委副书记、州长夏锡璠,副州长曾凡胜,州政府秘书长程飞一行莅临奥泰康北京总部考察调研,奥泰康期待借助自身CRO在医药科技成果转化方面的丰富经验与优势,助力恩施州传统中医药和硒产品的新药科技成果转化,实现优势互补、资源共享、共同推动生物医药行业高质量发展。
7月,恩施州州委副书记、州长夏锡璠,副州长曾凡胜,州政府秘书长程飞一行莅临奥泰康北京总部考察调研,奥泰康期待借助自身CRO在医药科技成果转化方面的丰富经验与优势,助力恩施州传统中医药和硒产品的新药科技成果转化,实现优势互补、资源共享、共同推动生物医药行业高质量发展。
作为唯一的CRO企业入选亿欧AI报告
 7月,世界人工智能大会中,亿欧发布的《2023中国人工智能医学影像产品生命周期研究报告》中,奥泰康作为医学影像赛道企业图谱中唯一的CRO企业入选报告。在AI医学影像产品的市场准入方面,奥泰康与众多头部AI企业合作,承担70余项AI产品的临床服务,累计助力合作企业获得AI三类医疗器械注册证14张。
7月,世界人工智能大会中,亿欧发布的《2023中国人工智能医学影像产品生命周期研究报告》中,奥泰康作为医学影像赛道企业图谱中唯一的CRO企业入选报告。在AI医学影像产品的市场准入方面,奥泰康与众多头部AI企业合作,承担70余项AI产品的临床服务,累计助力合作企业获得AI三类医疗器械注册证14张。
三类胶原贴敷料亮相2023CSD
 7月,奥泰康助力全国首个以细胞外基质来源的胶原蛋白为原料制备的三类胶原贴敷料亮相第28届全国皮肤性病学术年会,北京交通大学教授、生物材料与再生医学研究专家、奥泰康AOBM首席科学家王海滨教授应邀参加会议。与会专家对恒安芙林“丽点®胶原贴敷料”的有效性和安全性给予充分肯定,并对ECM胶原贴敷料核心技术给予高度评价。
7月,奥泰康助力全国首个以细胞外基质来源的胶原蛋白为原料制备的三类胶原贴敷料亮相第28届全国皮肤性病学术年会,北京交通大学教授、生物材料与再生医学研究专家、奥泰康AOBM首席科学家王海滨教授应邀参加会议。与会专家对恒安芙林“丽点®胶原贴敷料”的有效性和安全性给予充分肯定,并对ECM胶原贴敷料核心技术给予高度评价。
ECM生物凝胶产品-完成全部临床入组
 7月,细胞外基质(ECM)生物凝胶产品完成全部临床试验受试者入组。此产品是国内首个进入临床的ECM医美注射产品,也是最新一代天然再生类医美填充材料走向应用的重要里程碑,为将来产品注册和全国推广迈出关键性一步。
7月,细胞外基质(ECM)生物凝胶产品完成全部临床试验受试者入组。此产品是国内首个进入临床的ECM医美注射产品,也是最新一代天然再生类医美填充材料走向应用的重要里程碑,为将来产品注册和全国推广迈出关键性一步。
创新产品获批上市-静脉支架系统
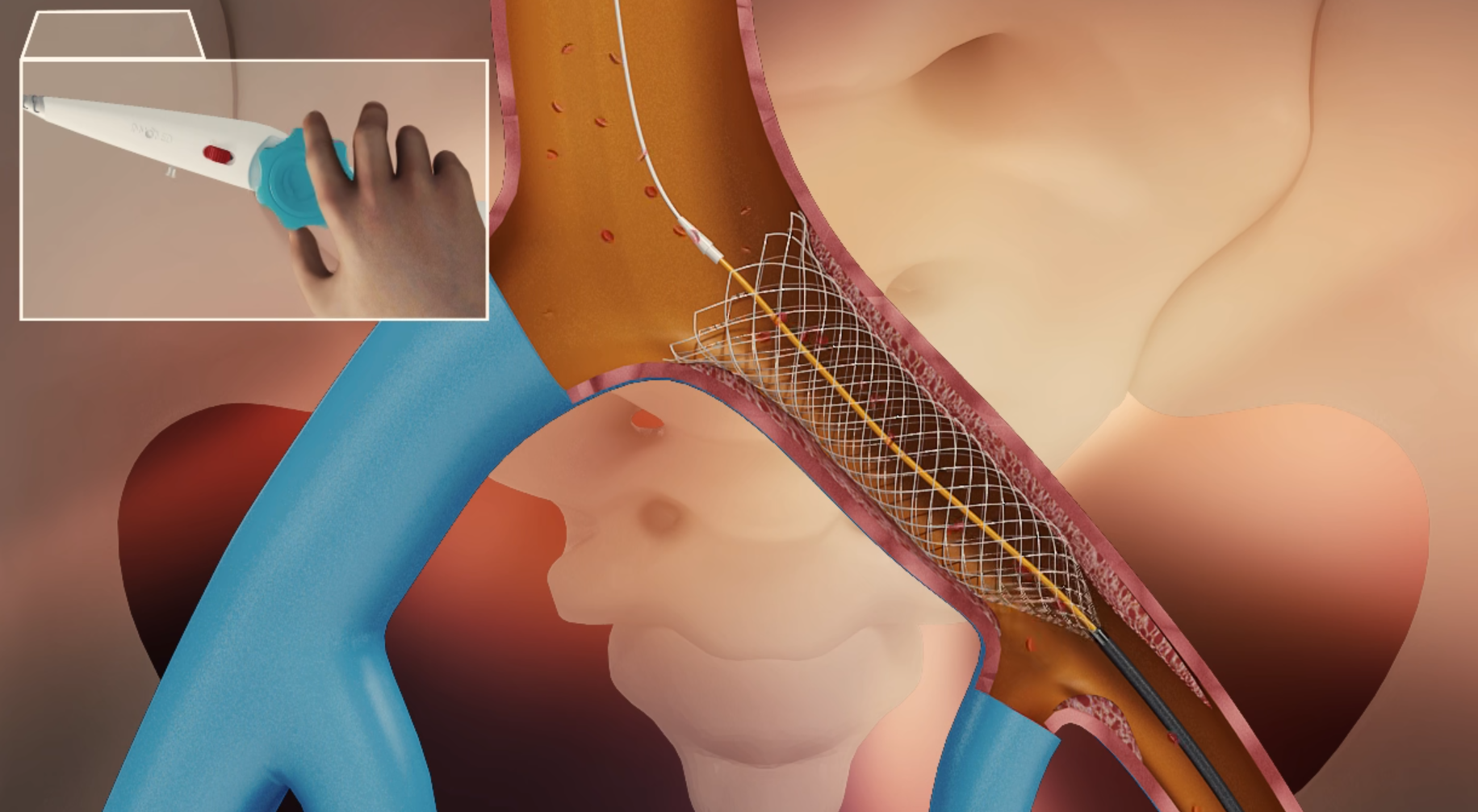 7月,经国家药品监督管理局公示,Inno-Xmart静脉支架系统(国械注准20233131034)获得NMPA批准上市,奥泰康承担本项目创新申报服务
7月,经国家药品监督管理局公示,Inno-Xmart静脉支架系统(国械注准20233131034)获得NMPA批准上市,奥泰康承担本项目创新申报服务
8月
北京CDMO中心获得生产许可证
 8月,奥泰康北京CDMO中心成功获得由北京市药品监督管理局颁发的创面敷料三类生产许可证(京药监械生产许20230053号),标志着北京CDMO中心已达到医疗器械产业化生产的法规要求,具备医疗器械生产条件并可以正式投产,对公司产业化进程具有重要里程碑式意义。
8月,奥泰康北京CDMO中心成功获得由北京市药品监督管理局颁发的创面敷料三类生产许可证(京药监械生产许20230053号),标志着北京CDMO中心已达到医疗器械产业化生产的法规要求,具备医疗器械生产条件并可以正式投产,对公司产业化进程具有重要里程碑式意义。
助力有源产品获证
 8月,超声高频集成手术设备(国械注准20233011251)获得NMPA批准上市,奥泰康承担本项目临床评价资料撰写服务,系奥泰康助力获得本年度第14张三类医疗器械注册证。
8月,超声高频集成手术设备(国械注准20233011251)获得NMPA批准上市,奥泰康承担本项目临床评价资料撰写服务,系奥泰康助力获得本年度第14张三类医疗器械注册证。
9月
临床注册部&项目运营中心临床培训
 9月,奥泰康2023年临床注册部及项目运营中心临床培训圆满结束,干货满满的培训议程具有极强的指导性和实用性,充分开拓了临床执行思路,促进了临床管理者和执行者间的学习与交流,为进一步提高临床试验项目质量保驾护航。
9月,奥泰康2023年临床注册部及项目运营中心临床培训圆满结束,干货满满的培训议程具有极强的指导性和实用性,充分开拓了临床执行思路,促进了临床管理者和执行者间的学习与交流,为进一步提高临床试验项目质量保驾护航。
奥泰康十七周年庆典暨颁奖晚会

9月,奥泰康十七周年庆典暨颁奖晚会隆重举行,线上直播平台同步分享盛况,十七载征程,见证了奥泰康以专业服务赋能医疗的坚定步伐,感恩一路陪伴的伙伴,见证和参与公司的成长,奥泰康将以专业服务赋能医疗,奋楫笃行,臻于至善。
全球首款用于阿兹海默症早期诊断的AI软件获批
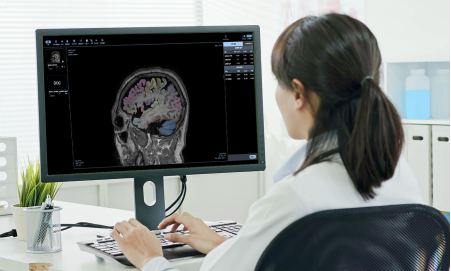
9月,磁共振图像辅助评估软件(国械注准20233211362)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第15张三类医疗器械注册证,也是奥泰康累计助力获得的第14张人工智能(AI)类医疗器械注册证。
10月
应邀参加泰州医博会

10月,奥泰康受邀参加第十四届中国(泰州)国际医药博览会,奥泰康CDMO中心在再生医学生物材料领域深耕多年,积累丰富项目经验及业内口碑,立足生物医用材料市场准入全流程解决方案,向大众展示了奥泰康医疗器械科技成果转化一站式服务,受到众多参会企业代表的肯定。
植入式眼部肌肉神经刺激器-完成全部临床入组
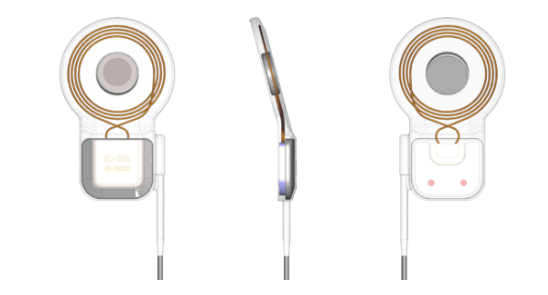
10月,创新医疗器械“植入式眼部肌肉神经刺激器”(i-NYS)中国境内临床试验完成全部受试者入组,奥泰康承担本项目临床试验服务,标志着由中国人自主研发制造的全球首款治疗先天性眼球震颤的神经刺激器产品迈出了走向市场的坚实步伐,对于眼科领域“不治之症”先天性眼球震颤的临床治疗具有突破性的里程碑意义。
奥泰康北京CDMO中心-乔迁仪式
 10月,奥泰康北京CDMO中心完成乔迁,研发生产车间规模进一步扩大,研发生产管线进行全面升级,厂房车间规模的扩大为企业发展奠定了坚实的基础,为集团的未来注入了新的活力。奥泰康作为创新及高端医疗器械优质服务商入驻园区,将依托专业服务吸纳更多专业化人才与科研力量,推动生物医药行业高质量发展。
10月,奥泰康北京CDMO中心完成乔迁,研发生产车间规模进一步扩大,研发生产管线进行全面升级,厂房车间规模的扩大为企业发展奠定了坚实的基础,为集团的未来注入了新的活力。奥泰康作为创新及高端医疗器械优质服务商入驻园区,将依托专业服务吸纳更多专业化人才与科研力量,推动生物医药行业高质量发展。
11月
助力外周产品通过创新审查
11月,一次性使用外周血管内超声导管及血管内超声治疗设备通过创新医疗器械特别审查,奥泰康承担本项目创新申报服务,截至目前,奥泰康已累计收获19项创新申报成功案例。
助力FFR软件获批
 11月,冠状动脉CT血流储备分数计算软件(国械注准20233211751)获得NMPA批准上市,系国内唯一采用全三维流体力学+超级计算机原理的FFRCT产品,奥泰康承担本项目注册申报服务,系2023年奥泰康助力获得的第17张三类医疗器械注册证。
11月,冠状动脉CT血流储备分数计算软件(国械注准20233211751)获得NMPA批准上市,系国内唯一采用全三维流体力学+超级计算机原理的FFRCT产品,奥泰康承担本项目注册申报服务,系2023年奥泰康助力获得的第17张三类医疗器械注册证。
再生医美项目-战略合作签约仪式
 11月,新氧科技与奥泰康举行战略合作签约仪式,双方开启深层次合作新篇章。此次合作系奥泰康CRO&CDMO一体化服务的又一标志性事件,未来,奥泰康将充分发挥市场准入全流程解决方案服务优势,推动再生医美产品进入市场,实现医美产品的全生命周期管理,为医美行业高质量发展贡献力量。
11月,新氧科技与奥泰康举行战略合作签约仪式,双方开启深层次合作新篇章。此次合作系奥泰康CRO&CDMO一体化服务的又一标志性事件,未来,奥泰康将充分发挥市场准入全流程解决方案服务优势,推动再生医美产品进入市场,实现医美产品的全生命周期管理,为医美行业高质量发展贡献力量。
12月
助力可吸收缝合线获批
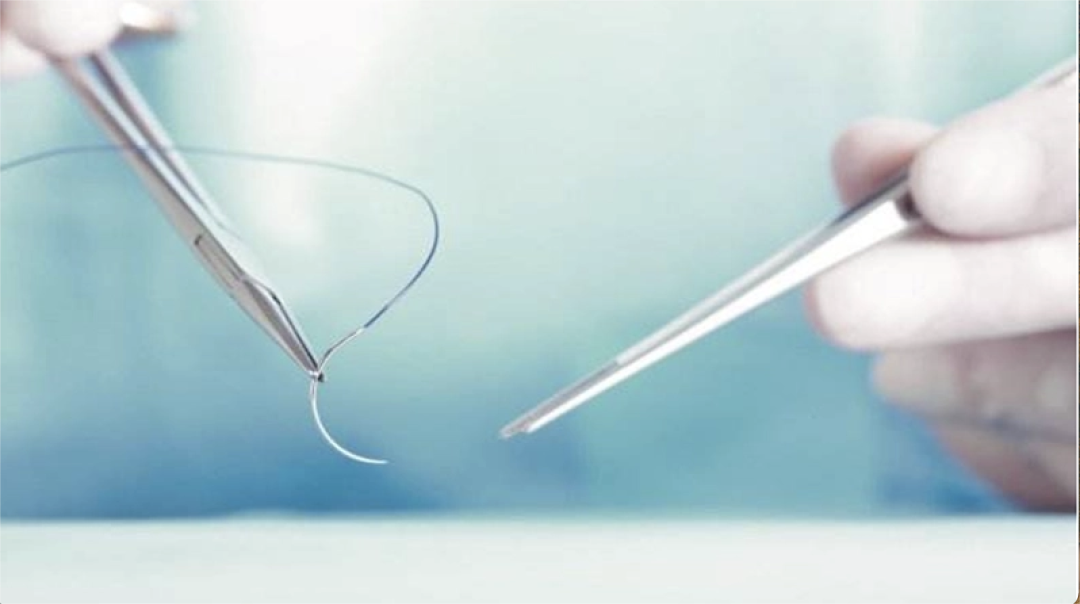 12月,可吸收胶原蛋白缝合线(国械注准20233021868)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第18张三类医疗器械注册证。
12月,可吸收胶原蛋白缝合线(国械注准20233021868)获得NMPA批准上市,奥泰康承担本项目临床试验服务,系2023年奥泰康助力获得的第18张三类医疗器械注册证。
凯歌而行,不以山海为远
乘势而上,不以日月为限
2023年度
奥泰康已累计助力21款产品获批上市
未来,奥泰康将深耕CRO&CDMO服务
用实际行动达成更多的里程碑
行而不辍,未来可期
愿与您一路
奔赴崭新的2024!