
引言
前研系列「轻医美」时代来临,注射类医美热度不减,再生材料彰显潜力💉前言
近年来,医疗美容成为发展迅速的热点领域,监管趋严、消费升级、颜值经济、技术进步等因素共同推动医美行业的快速发展。轻医美项目凭风险低、创伤小、恢复期短成为当下热门,其中注射填充类材料根据用户需求持续更新,玻尿酸、肉毒素、骨性材料、羟基磷灰石、胶原蛋白、活性材料、再生材料等材料百花齐放,其中再生材料发展迅速且极具潜力,本篇带大家了解注射类再生材料相关内容。
注射类占比逐年增加,有望成为医美行业新增量
市面上将非手术类项目统称为“轻医美”,轻医美项目包括注射类、光电类及其他项目,相较于传统医美项目,轻医美项目凭风险低、创伤小、恢复期短成为当下热门,在医美市场中占据半数以上的市场份额。新氧颜究院数据显示,2022年上半年,非手术类医美占比达60.72%,占医美整体市场一半有余。
随着轻医美市场的快速增长,微创注射类手术也在不断地提升市场占比。头豹研究院《2023年中国医美再生注射剂行业概览》预测,到2027年,中国大陆医美再生注射剂市场空间可达到约115.2亿元人民币,2025-2027年期间复合增长率约为31.2%,持续升温的医美领域也驱动着注射类填充类材料的研发脚步。
从填充到再生,再生材料热度增长最快
以玻尿酸、肉毒素为代表的物理填充,在注射医美占比约为2/3、1/3,2021年国内再生针剂陆续获批上市,包括长春圣博玛及北京爱美客自主研发的两款童颜针,以及华东医药通过收购英国Sinclair公司引进的少女针产品。
再生医学作为科学及技术交叉应用的前沿医学领域之一,在“十三五”“十四五”期间,一直被纳入我国生物科技研发重点支持领域。方正证券数据显示,我国再生医美市场空间将在 2025 年增长到近30亿元,持续保持每年20%以上的增长率,未来有望成为医美注射市场的“顶流吸金兽”。新氧发布的《2022年中国注射类医美行业分析报告》也显示,注射细分赛道中再生材料填充热度上升迅速。
应用场景拓宽,注射再生材料推陈出新
再生生物材料是再生医学领域中起步较早、发展较迅速的细分赛道,已有多款产品上市,进口替代效应显现。再生材料是能够刺激人体纤维细胞和胶原蛋白再生的新型材料,注射后起到结构重塑和容积填充作用,达到抗衰目的,效果通常比玻尿酸更加持久。
近年来,得益于医美行业技术更迭及医美市场渗透率加快,再生材料的应用场景从医疗端逐渐拓展至医美端,并推动医美注射产品种类丰富和功效优化,医美新材料上游市场进入更高质量的竞争阶段,很多极具潜力的再生材料被用于医美注射填充剂的研发,产品将用于纠正鼻唇沟、颈纹、泪沟、法令纹等。

丝素蛋白(Silk Fibroin,SF),作为天然的“再生类”填充材料,具有更为安全和高效的优势,可达到即时填充和刺激胶原蛋白再生的效果,达到长期组织替代作用,其具有良好的生物相容性、细胞黏附特性、机械强度以及可调控的体内降解速率,目前已被广泛用于生物医学与组织再生等领域。
纵观全球市场,早在1993年,丝素蛋白就已被美国食品和药物管理局(FDA)批准用于生物医学应用,通过了生物相容性和安全性测试并符合医学标准。随着再生类材料的热度升高,诸多头部企业也在积极布局丝素蛋白赛道,足以窥见丝素蛋白作为医美注射填充针剂的发展潜力。
2021年6月,苏州苏豪生物材料科技有限公司研发的丝蛋白创面敷料获得NMPA批准上市(苏械注准20162140234),产品适用于非慢性创面的护理,临床浅Ⅱ度、Ⅰ度烧伤创面的护理,系丝素蛋白首个二类注册证。
2021年9月,Galderma与美国Sofregen Medical达成独家战略合作,共同开发基于蚕丝蛋白材料创新应用技术的新一代皮肤填充剂。
2022年1月,复锐医疗科技与复星医药旗下基金签订协议成立天津星丝奕生物科技有限公司,推进丝素蛋白透明质酸钠复合凝胶的研发和生产。
2023年11月,新氧科技布局丝素蛋白透明质酸钠复合溶液,以及细胞外基质生物注射凝胶共两项再生品类的研发生产,夯实了再生赛道产品矩阵。
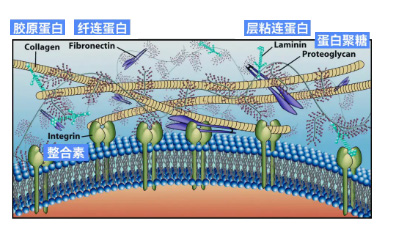
细胞外基质(extracellular matrix,ECM)是一类具有诱导组织修复与再生的天然材料,是细胞生存的微环境与细胞共同组成人体组织和器官,其由各种蛋白和多糖组成的复杂三维网络结构,为组织和器官提供稳定的信号传送和结构支持,不仅具有良好的生物相容性,还有极强的内源性组织诱导能力,非常适合细胞的黏附和生长,并在植入后调控和加速组织修复过程,可应用于填充组织缺失空隙、诱导组织再生、修复受损组织、完成周边组织整合。
不同于其他材料,细胞外基质由细胞分泌,无论在结构上还是功能上都最接近人体细胞微环境,ECM因其能够起到较好的修复和再生功效,而被认为是适用于再生医学的新一代生物材料,在创面修复、美容护肤、抗衰老方面有巨大优势。
2023年5月9日,湖北恒安芙林药业股份有限公司取得国家药监局批准的三类医疗器械注册证(国械注准20233140615),系全国首个以细胞外基质来源的胶原蛋白为原料制备的三类胶原贴敷料。
2023年7月,圣至润合(北京)生物科技有限公司的细胞外基质(ECM)生物凝胶产品完成临床试验全部受试者入组,系国内首个进入临床的ECM医美注射产品。
医美产品临床试验增加,法规政策趋于完善
随着注射类医美产品研发热度增加,产品上市前的临床试验也逐渐增多,国家药监局相关政策不断完善。
2022年3月30日
国家药品监督管理局发布关于调整《医疗器械分类目录》部分内容的公告,明确水光针(注射用透明质酸钠溶液)按照三类器械监管。
2023年5月17日
 为进一步规范透明质酸钠复合溶液产品临床试验,加强该类产品的监督管理,药监局发布水光针临床试验技术审评要点,编制了《透明质酸钠复合溶液临床试验技术审评要点(征求意见稿)》。
为进一步规范透明质酸钠复合溶液产品临床试验,加强该类产品的监督管理,药监局发布水光针临床试验技术审评要点,编制了《透明质酸钠复合溶液临床试验技术审评要点(征求意见稿)》。
2023年12月11日
 为进一步规范面部注射填充材料产品上市前的临床试验,国家药监局器审中心发布《面部注射填充材料临床试验注册审查指导原则(征求意见稿)》,针对不用材料面部注射产品临床试验中的适用范围、试验设计、临床评价指标、样本量、入排标准等进行了规范。
为进一步规范面部注射填充材料产品上市前的临床试验,国家药监局器审中心发布《面部注射填充材料临床试验注册审查指导原则(征求意见稿)》,针对不用材料面部注射产品临床试验中的适用范围、试验设计、临床评价指标、样本量、入排标准等进行了规范。
结语
当下,新材料产业已然成为我国蓬勃发展的战略性新兴朝阳产业之一,生物医用材料正处于从第一代传统惰性材料向第三代组织再生材料快速过渡的关键时期,人们对面部抗衰的重视程度也使市场对原料本身提出了更高的要求,唯有顺应时代发展趋势的材料才能在加速变革的潮流中屹立不倒,满足临床的需求。