国家药监部门贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》和中办、国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,深入推进医疗器械审评审批制度改革,推动医疗器械创新发展。
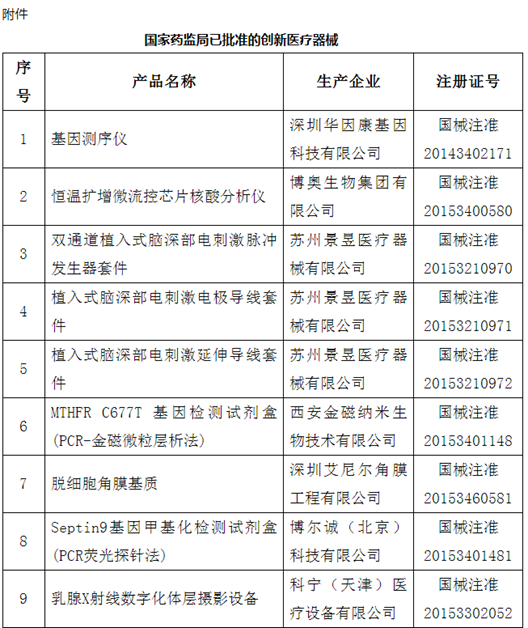
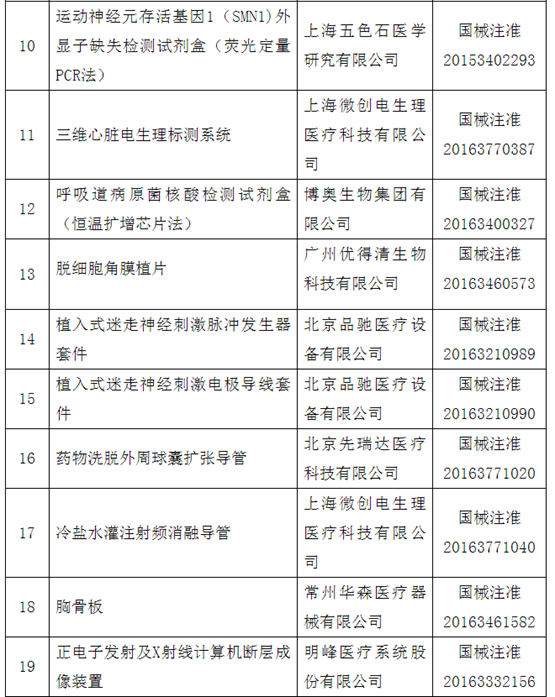
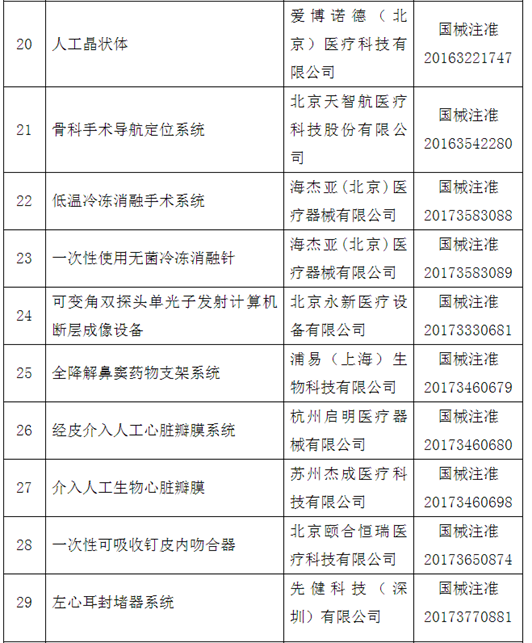
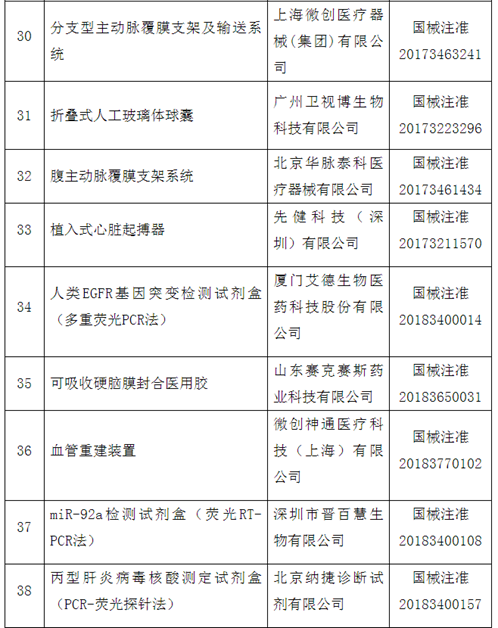
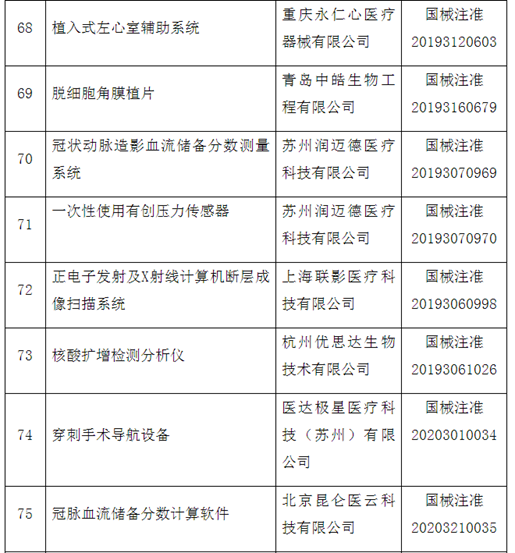
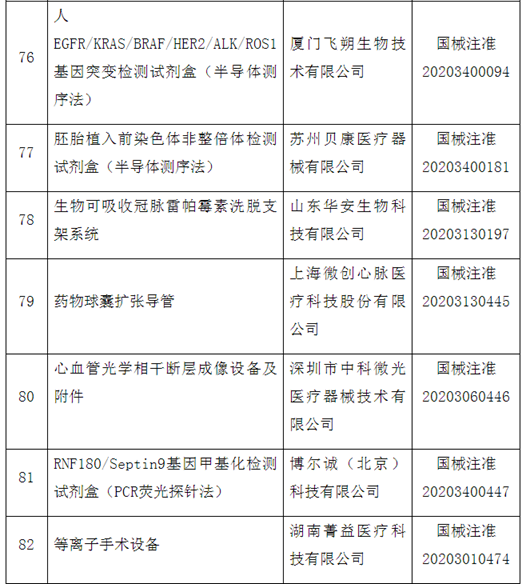
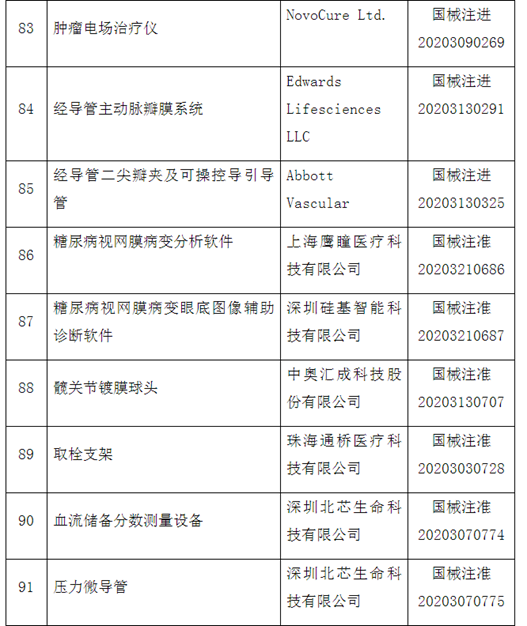
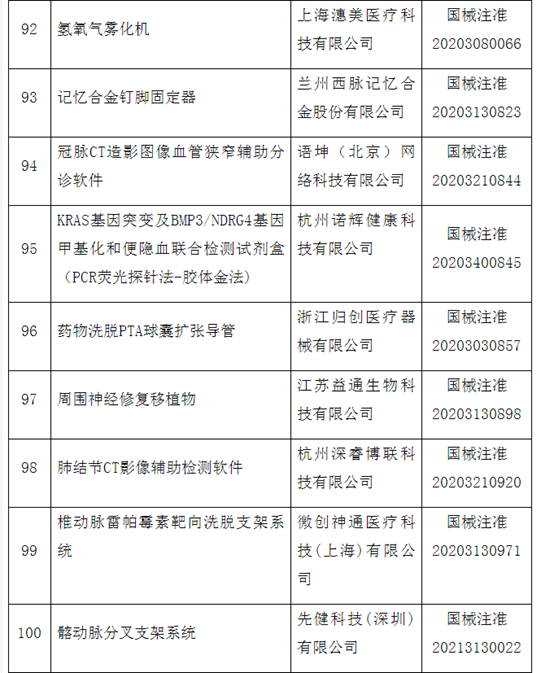
自2014年创新医疗器械“绿色通道”开启,截至2020年12月底,已经有1471个产品申请进入创新通道,292个产品作为创新医疗器械被纳入该通道,约占全部申请项目的20%左右。截至目前,共批准100个创新医疗器械上市。奥泰康参与完成了其中15个创新医疗器械申报,涵盖神经外科、心血管科、眼科、放射影像科、介入科等领域,项目如“双通道植入式神经刺激系统”、“外周血管支架”、“人工角膜“、“冠状动脉供血功能评估软件(FFR)”、”IQQA-Guide三维影像术中导航系统”等。
作为业内具有15年项目经验的CRO公司,奥泰康致力成为医药行业MA解决方案领导者,为健康事业持续创造新的价值。集团通过提供时效性强、成本可控、质量有保障和专业性的研究开发、产品检测、动物实验、临床试验和产品注册全程解决方案,持续推动安全、有效和质量可控的产品进入市场,保障人类生命健康。未来,奥泰康将持续着力于创新医疗器械和高端医疗器械CRO服务,尤其在心脑血管、神经介入、肿瘤、骨科、影像、整形美容六大领域。
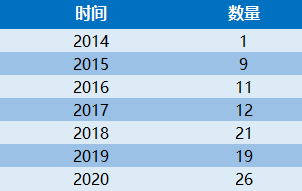
近年来,创新医疗器械获批数量基本成逐年增加趋势,2014年批准1个创新器械,2015年批准9个,2016年批准11个,2017年批准12个,2018年批准21个,2019年批准19个,2020年批准26个。
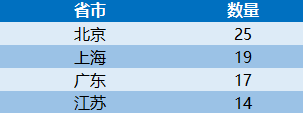
这100个产品中,国产产品96个,涉及14个省、自治区和直辖市78家医疗器械企业,占全部产品的96%,进口产品4个,涉及2个国家,4个企业。从批准产品所在地来看,产业大省创新医疗器械数量排名靠前,分别是北京25个、上海19个、广东17个、江苏14个。
从产品特性看,有源器械43个,无源器械37个,体外诊断试剂和设备20个。

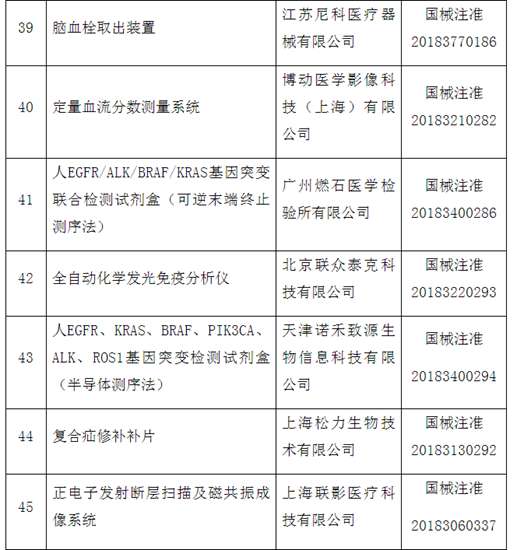
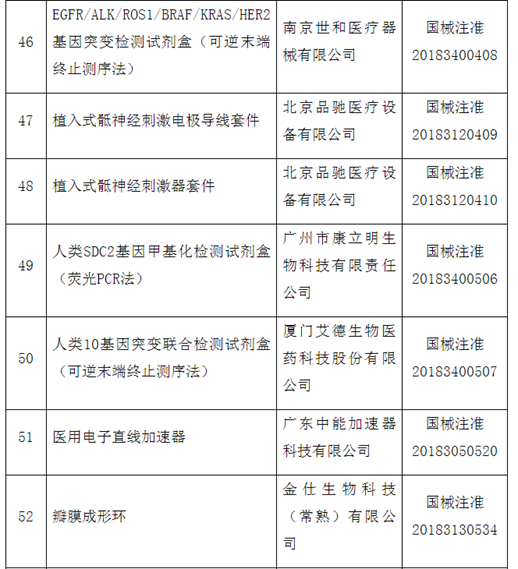
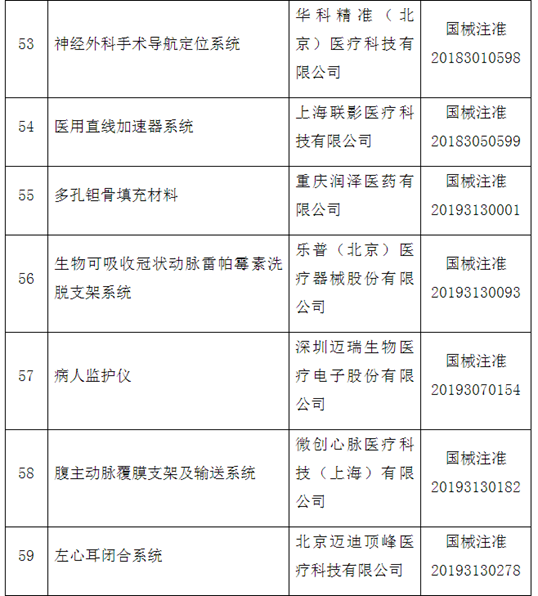
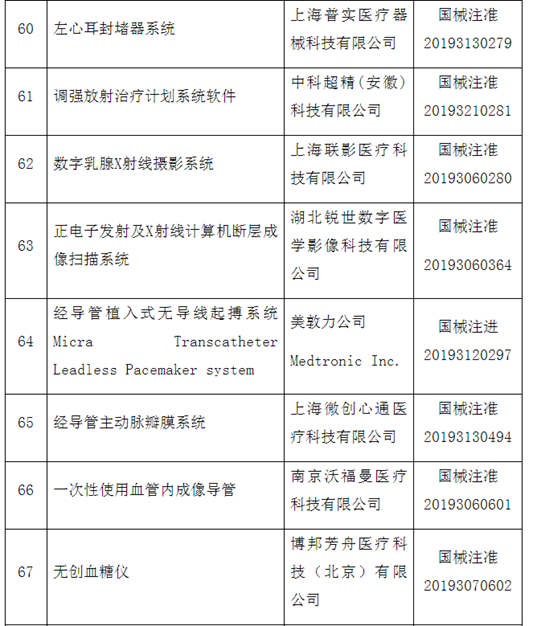
附件:100个国家药监局已批准的创新医疗器械