
01
引言
近年来,随着医疗需求日益增长,医疗器械已成为我国生物医药产业中发展最迅速的细分行业,心血管类产品成为创新医疗器械特别审批通道的重点领域,其中介入治疗技术发展迅速,2019年国内血管疾病患病数高达4.706亿人,手术量高达133.88万,随着血管疾病患病率上升,手术量预计将以15.07%复合年增速增长,进而推动介入相关医疗器械需求量。
2020年4月,奥泰康助力【多分支人工血管覆膜支架系统】通过创新医疗器械审批,该医疗器械的诞生,为主动脉夹层疾病的治疗提供了更加优异的选择。
02
疾病背景
什么是主动脉夹层?
主动脉夹层是一种凶险的心血管急症,由于主动脉管壁内膜出现破口,血液由此进入动脉壁中层,形成夹层血肿,并逐渐延伸剥离主动脉的内膜和中膜。患者出现刀割样疼痛、恶心、呕吐等症状,主动脉夹层需紧急医学治疗,一旦发病可能导致主动脉破裂,严重威胁患者生命安全。
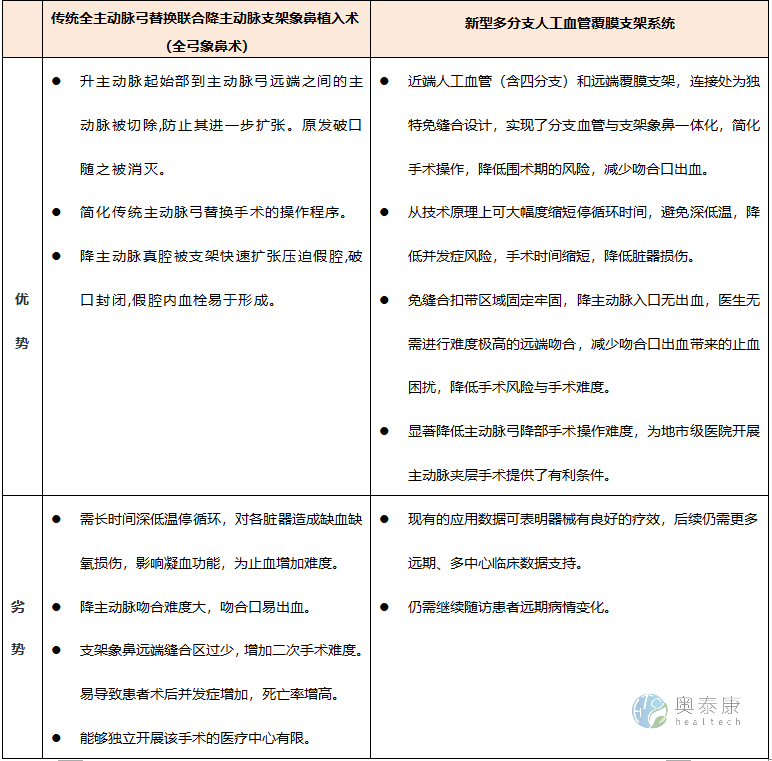
主动脉夹层是心血管疾病中死亡风险最高的疾病之一。临床可分为Stanford A型和B型,其中A型死亡风险更高,发病48 h自然病死率高达50%。目前主动脉夹层的治疗方案众多,对于累及升主动脉或主动脉弓的主动脉夹层,仍以外科手术作为主要治疗手段。随着治疗技术的不断发展与经验的累积,全主动脉弓替换联合降主动脉支架象鼻置入术(简称全弓象鼻术)已成为国内外治疗累及弓部主动脉夹层的标准手术方案。
虽然经典的手术方式在近15年间飞速发展,但仍存在诸多临床弊端。随着医疗产品研发技术突飞猛进,创新型医疗器械——多分支人工血管覆膜支架系统问世,弥补了传统手术中的部分不足,为广大患者带来福音。
03
传统主动脉夹层手术vs多分支人工覆膜支架系统手术的对比
04
奥泰康临床注册团队助力【多分支人工血管覆膜支架系统】创新审批
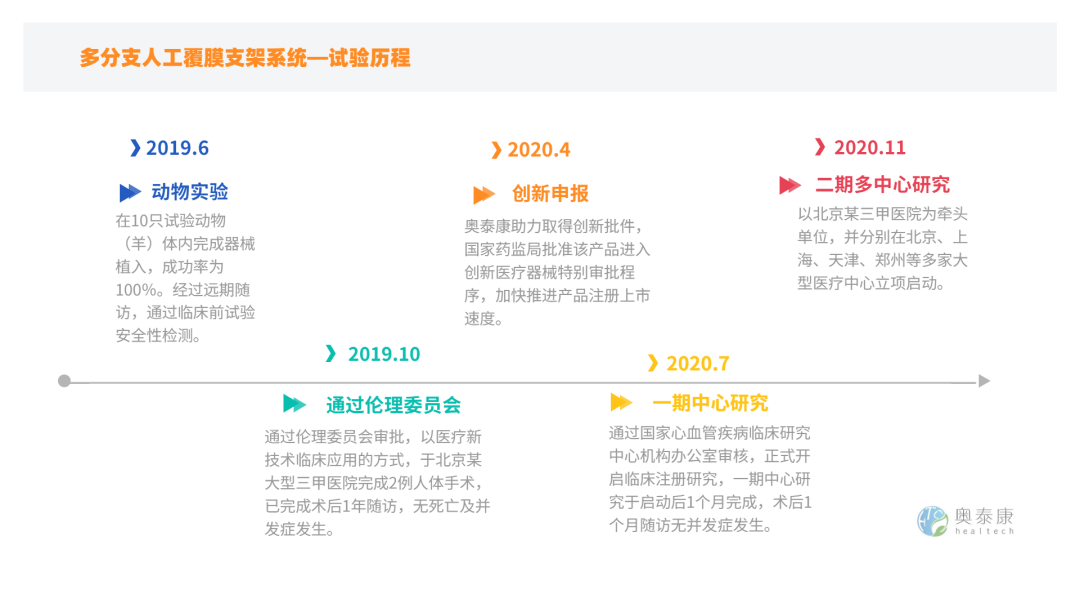
目前处于二期多中心试验入组阶段,若试验进行顺利,产品有望于2022年获得国家药监局批准上市
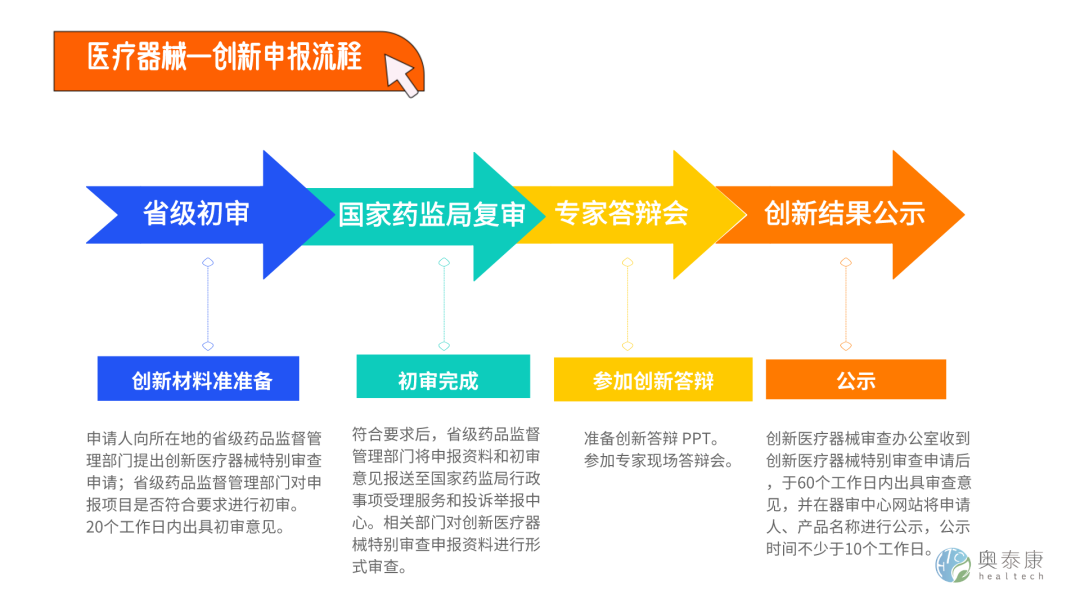
医疗器械的产品从研发定型到最后取得注册证,整个流程动辄需要两到三年甚至更长时间。为鼓励医疗器械创新,促进医疗器械新技术推广和应用,国家药监局于2018年11月发布了《创新医疗器械特别审查程序》,为进一步深化医疗器械审评审批改革,保障医疗器械临床使用需求,药监局于2016年10月25日发布《医疗器械优先审批程序》。创新医疗器械特别审查程序和医疗器械优先审批程序是医疗器械审批两大“绿色通道”, 一旦通过了创新审批,进入“绿色通道”,可享有审评部门早期介入、专人负责、提供指导、优先审评、加强沟通(包括检测环节都能优先)等诸多VIP待遇,为企业节约大量时间,缩短产品上市时间,而产品通过创新通道审批,足以说明创新审查专家对申报产品创新性以及临床价值方面的认可。
05
创新申报经验分享
奥泰康在医疗器械注册申报领域深耕细作,为客户担任创新医疗器械咨询服务顾问,助力多项产品通过创新审批,逐步探索与发展过程中,我们梳理出3个容易影响审批失败的环节进行逐一阐述。
● 知识产权情况及证明文件
① 未通过创新审批流程的产品,50%原因都与专利相关资料相关。
② 已授权的专利需尽快申请创新医疗器械特别审查,时间不得超过5年。
③ 专利主体人与申报主体需保持一致,专利持有人需是申报的主体。
④ 专利权利要求中,某一部分能体现新颖性和创造性即可,权利要求书中不用全部满足。
⑤ 专利描述必须有应用场景,描述须具体,避免遗漏导致审批失败。
● 产品创新性的证明文件撰写需严谨
① 需与临床专家深入讨论,从专家角度沟通产品的创新意义,突出产品在临床应用中的显著价值,提高审批通过可能性。
② 重视临床意义部分,需挖掘创新点,详细深入写明产品创新技术和工艺为临床带来的核心价值,不可照搬文献使临床意义浮于表面。
③ 审评专家对真实人体实验数据感兴趣,可进行1-2例人体试验,获得临床数据,收集病例入院信息、图片、手术数据结果,形成报告后再进行创新申报,有助于提高通过率。
● 创新答辩会注意事项
① 答辩PPT需体现团队各方,包括研发、注册等,展现研发实力和研究团队既往成果,体现团队成熟性和产品质量可控性。
② 可在会上播放动物实验录像、产品照片、DOMO视频等,使专家更快熟悉产品,增加答辩通过率。
③ 会前一天需提前模拟答辩,控制答辩时间,拟好汇报思路,抓住汇报重点;测试好设备端口,保证设备稳定。
④ 答辩技巧上,尽量用数据与法规回答专家提问,避免用主观推论或未加验证的结论回答,保证专业性。
截至目前,已上市的117个创新医疗器械中,奥泰康完成的创新医疗器械申报项目有16个,占比13.68%。由于政策审批流程的严苛和市场准入门槛的提高,创新批件审批总体通过率不足20%,而奥泰康的通过率达100%,其中涵盖心血管、AI软件、神经外科、生物补片、导航系统等多个领域。